二氧化碳的实验室制取
一、实验是制取二氧化碳的的化学反应原理
1.在实验室里,常用____________与__________(或___________,主要成分都是___________)反应来制取二氧化碳。
2.反应的化学方程式:______________________。
【思考与讨论】
确定实验室里制取二氧化碳的化学反应原理时,需要考虑哪些因素?
(1)为什么不用碳酸钠与稀盐酸?
(2)为什么不用大理石后石灰石去稀硫酸?
(3)确定反应原理时,需要考虑哪些因素?
二、实验室制取二氧化碳的装置
【问题】
如何设计实验室里制取二氧化碳的装置?
【方案设计】
实验室里制取气体的装置一般包括____________和____________。
1.确定气体发生装置的依据
从实验室制取气体的原理出发,根据____________(如固体与固体反应、固体与液体反应 、液体与液体反应等)、____________(如是否需要加热、使用催化剂等)来确定气体发生装置。
2.确定气体收集装置的依据
(1)根据气体的____________选择气体收集方法(____________或____________),确定气体收集装置。

(2)当采用排空气法时,如果气体的密度比空气的大, 采用_______排气法;如果气体的密度比空气的小, 采用_______排气法。当气体的密度与空气的密度相近且难溶于水时,一般采用_______。
(3)空气的平均相对分子质量为_____ 。如果某气体的相对分子质量大于29 ,则这种气体的密度比相同状况下空气的_____;如果小于29 ,则其密度比相同状况下空气的_____。
3.选择仪器,设计装置
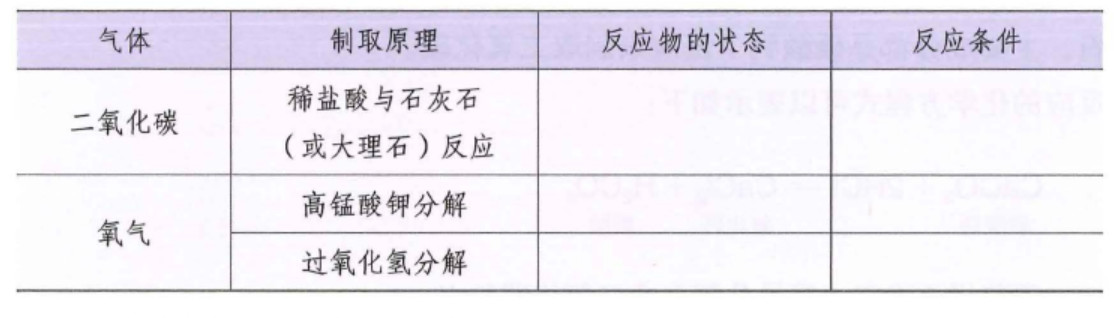
在实验室里,制取二氧化碳的发生装置可以选用__________,收集装置可以选用__________,来制取二氧化碳。如下图:
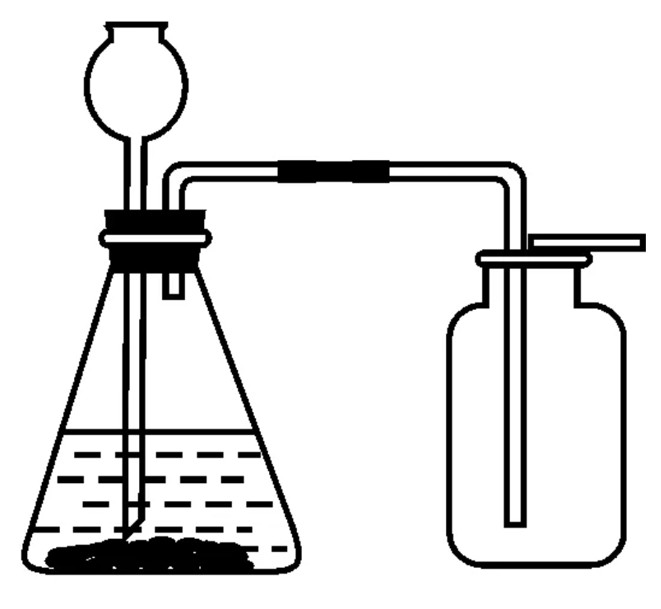
【思考与讨论】
请根据二氧化碳的性质讨论:
(1)怎样检验生成的气体是二氧化碳?
(2)用集气瓶收集二氧化碳时,怎样证明集气瓶中己充满了二氧化碳?
三、实验室制取气体的一般思路
1.确定制取气体的化学反应原理:在实验室条件下(如常温、加热、使用催化剂等),选择什么试剂、通过什么反应来制取这种气体。确定原理时,需要综合考虑反应的_______大小,产生的气体是否易于_______、是否_______,实验操作是否简单、安全,实验过程是否会产生污染,以及试剂的_______等因素。
2.设计制取气体的实验装置:根据______________和______________确定气体发生装置根据气体的_______(如密度、是否溶于水、是否与水反应等)确定气体收集装置(如有必要,还应考虑除去杂质的装直和尾气处理装置等)
3.验证得到的气体就是所要制取的气体:根据气体的_______(如可燃性或助燃性、与某些试剂反应有沉淀生成等)进行验证。
必记知识点
一、药品选择
1.药品:大理石(或石灰石)与稀盐酸
2.不能用稀硫酸代替稀盐酸:碳酸钙与稀硫酸反应生成硫酸钙微溶于水,覆盖在大理石(或石灰石)表面,阻止反应进行。
3.不能用碳酸钠与稀盐酸反应:反应速率过快,不便于收集
二、反应原理
三、气体发生装置的选择
1.选择依据:反应物的状态与反应条件
2.常用装置类型
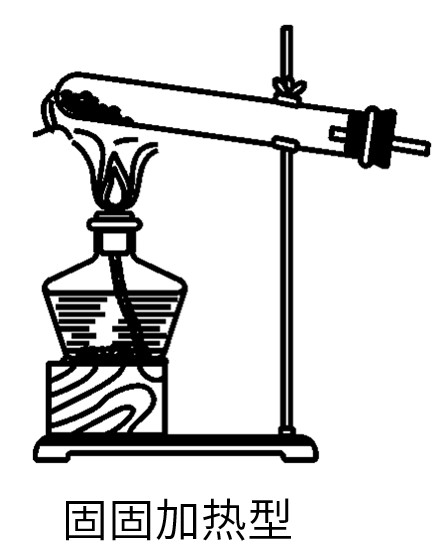
(1)固固加热型:反应物的状态是固体和固体,需要加热
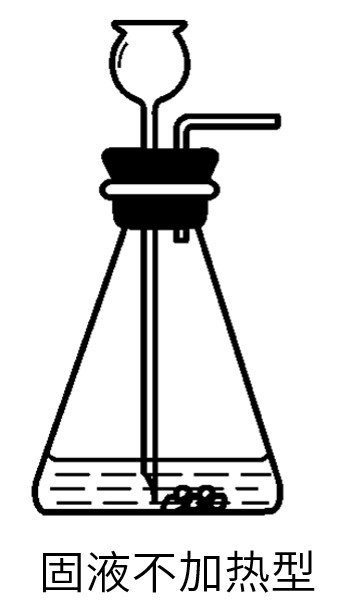
(2)固液不加热型:反应的状态是固体和液体,不需要加热
3.实验室制取二氧化碳发生装置
实验室制取二氧化碳药品是大理石或石灰石(固体) 、稀盐酸(液体) ,不需要加热,所以选择固液不加热型装置
四、气体收集装置的选择
1.选择依据:气体的性质(溶解性、密度)
2.常见装置类型
(1)排水法:不溶于水,不与水反应

(2)排空气法:气体的密度比空气的大, 采用向上排气法;气体的密度比空气的 小, 采用向下排气法
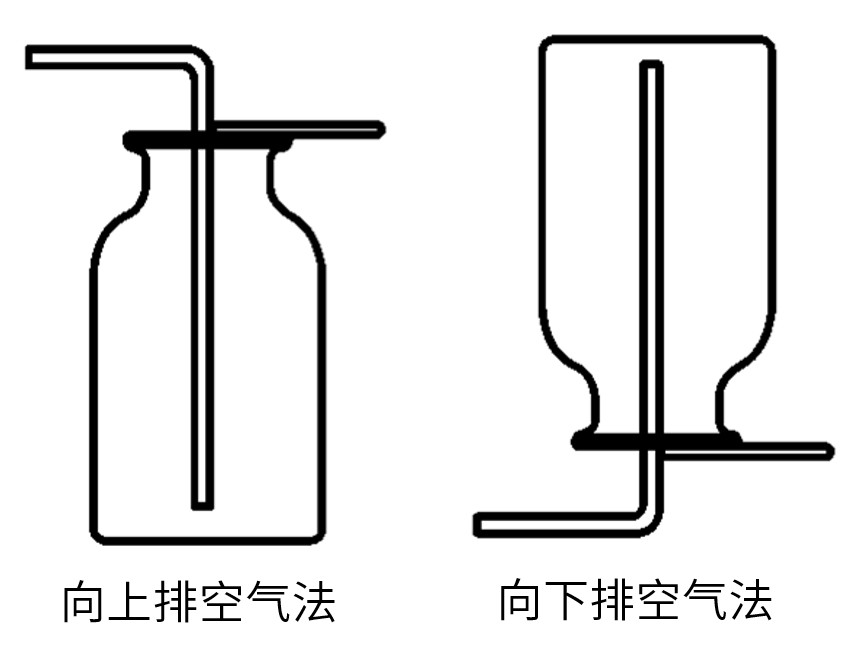
3.实验室制取二氧化碳收集装置
因为二氧化碳能溶于水,且会与水发生反应,所以不能选择排水法收集
二氧化碳密度比空气大,可以选择向上排空气法收集
4.实验室制取二氧化碳的装置(包含发生装置和收集装置)
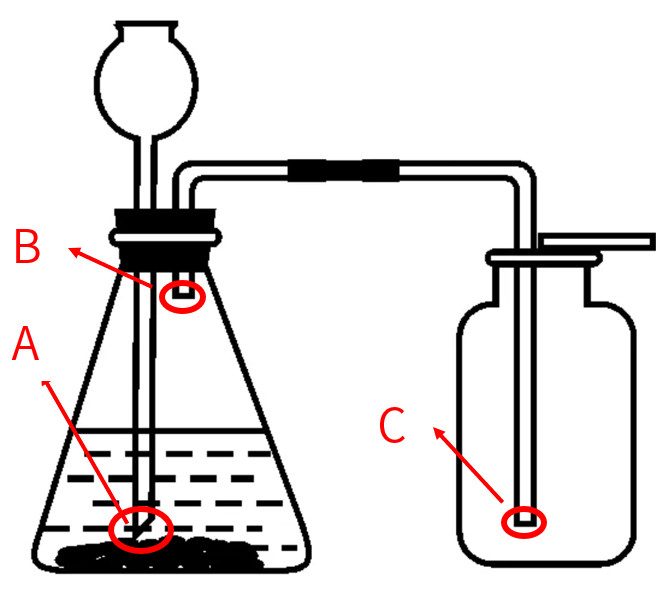
(1)A处长颈漏斗末端插入液面以下,形成液封:防止气体从长颈漏斗口逸出
(2)B处导管不能伸入过长:不利于气体排出
(3)C处导管要伸入集气瓶底部:便于将空气排尽
五、二氧化碳的检验与验满
1.二氧化碳的检验:将气体通入澄清的石灰水,若澄清的石灰水变浑浊,则证明气体是二氧化碳(注意不能用燃着的木条去检验二氧化碳)
2.二氧化碳的验满:将燃着的木条放在集气瓶口,若木条熄灭,则证明已集满