碳的氧化物
一、二氧化碳
1.二氧化碳的性质和用途
(1)【实验6-3】
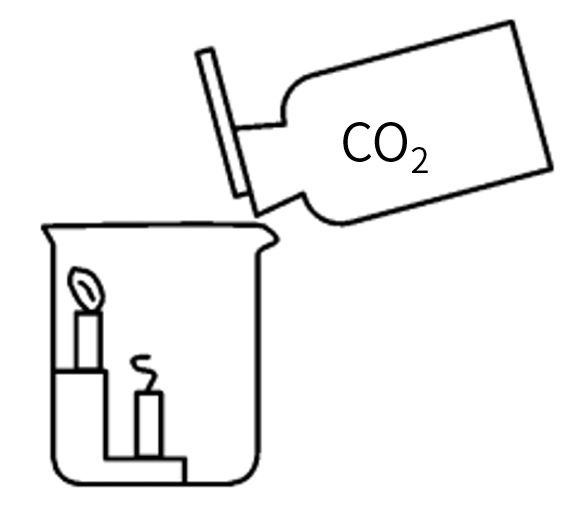
将二氧化碳气体慢慢倒入烧杯中,观察现象并分析。
①现象:蜡烛至______(“上”或“下”)而______(“上”或“下”)依次熄灭。
②分析:___________________________。
③结论:___________________________。
(2)【实验6-4】
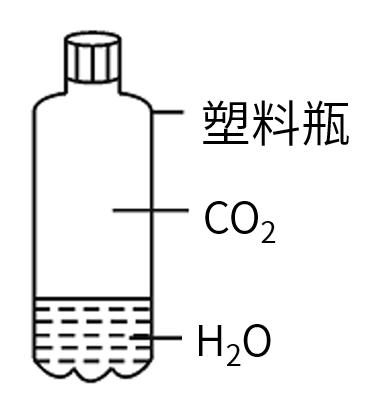
向一个收集满二氧化碳气体的质地较软的塑料瓶中加入约1/3容积的水,立即旋紧瓶盖,振荡。观察现象并分析。
①现象:塑料瓶变___。
②分析:___________________________。
③结论:___________________________。
(3)【实验6-5】
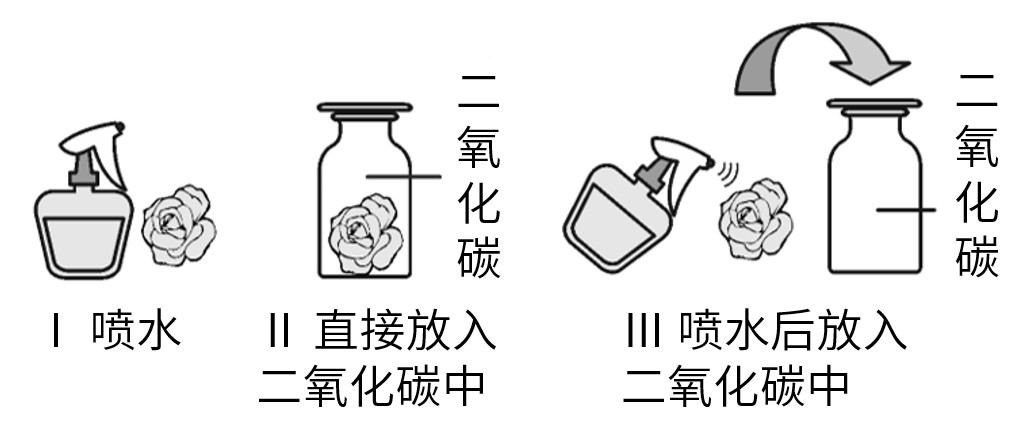
取三朵用石蕊溶液染成紫色的干燥的纸花。向第一朵纸花喷水;将第二朵纸花放入盛满二氧化碳的集气瓶中;将第二朵纸花喷上水后,再放入盛满二氧化碳的集气瓶中。观察三朵纸花的颜色变化。将第三朵纸花取出,小心地用吹风机吹干,观察现象。
①现象:实验Ⅰ中纸花___________,实验Ⅱ中纸花___________,实验Ⅲ中纸花___________,吹干第三朵纸花,纸花___________。
②分析:___________________________。
③结论:___________________________。
(4)二氧化碳的性质归纳
物理性质:
①二氧化碳是一种_______色,_______味的_______,密度比空气_______,_______溶于水;
②空气的平均相对分子质量为_____ 。如果某气体的相对分子质量大于29 ,则这种气体的密度比相同状况下空气的_____;如果小于29 ,则其密度比相同状况下空气的_____。
化学性质:
③二氧化碳_______(“能”或“不能”)燃烧,也_______(“支持”或“不支持”)燃烧。
④二氧化碳能与_______反应生成_______,化学方程式:____________________;
碳酸不稳定,容易分解成_________和___________,化学方程式____________________。
⑤二氧化碳能使澄清石灰水_______,因为二氧化碳与___________反应,生成了白色的___________沉淀,化学方程式____________________,这个反应可以用于_______二氧化碳。
(5)固态的二氧化碳叫_______,升华时吸收大量的热,因此可作_________和_________。
(6)二氧化的用途:光合作用的原料,__________,化工产品的原料,__________。
2.二氧化碳对生活和环境的影响
(1)二氧化碳本身没有毒性,但二氧化碳________(“能”或“不能”)供给呼吸。当空气中的二氧化碳超过正常含量时,会对人体健康产生影响,在人群密集的地方需要_________。
(2)温室效应
①大气中的二氧化碳就像温室的玻璃或塑料薄膜一样,既能让阳光透过,又能吸收地面散发的热量,起到了使地球升温的作用,这种现象叫作__________。
②能产生温室效应的气体除了二氧化碳,还有__________、__________、__________、__________。
③温室效应增强的原因:一方面____________________,另一方面____________________。
④温室效应的危害:____________________,____________________。
3.低碳行动与可持续发展
(1)为应对全球变暖这一重大挑战,实现人类社会可持续发展,国际社会倡导采取___________,控制大气中二氧化碳的含量,防止温室效应进一步增强。
(2)低碳行动:世界各国签署限制二氧化碳排放的国际公约,并严格执行;减少使用__________燃料,更多地利用__________、__________等清洁能源;促进节能产品和技术的进一步开发和普及,提高能源的生产效率和使用效率;大力__________,严禁__________;采用物理、化学等方法,__________、__________与__________二氧化碳等。
二、一氧化碳
1.物理性质:一氧化碳是一种_______色、_______的气体,_______溶于水。
2.化学性质:
(1)毒性:一氧化碳极易与人体血液中的___________结合,使血红蛋白不能再与氧气结合,造成人体缺氧,严重时会危及生命。因此,冬天用煤火取暖时,一定 要装烟囱,并且注意室内_______,防止一氧化碳中毒。
(2)可燃性
①一氧化碳能够燃烧,放出大量的热,火焰呈_______色,一氧化碳是_______等气体燃料的主要成分(可作燃料)。
②化学方程式:____________________
(3)还原性
①一氧化碳和木炭一样具有_______性,能使氧化铜还原成铜,同时生成_______,化学方程式____________________。
②一氧化碳的还原性可用于_______工业,可用一氧化碳的还原性来炼铁,化学方程式____________________。
3.常见的碳的氧化物有_________和_________,它们性质有很大不同的原因是_____________。
【思考与讨论】
煤气厂为什么在家用煤气(含有一氧化碳)中掺入微量具有难闻气味的气体?如果发生煤气泄漏应该怎么办?
必记知识点
一、实验
1.二氧化碳倾倒实验
现象:蜡烛至下而上依次熄灭
分析:二氧化碳密度比空气大,倾倒时会在烧杯底部先聚积较多的二氧化碳,在下方蜡烛首先接触到较多的二氧化碳而先熄灭,上方的蜡烛后接触到二氧化碳而熄灭
结论:二氧化碳不能燃烧,也不支持燃烧(化学性质);密度比空气大(物理性质)
2.二氧化碳的溶解性实验
现象:塑料瓶变瘪
分析:二氧化碳溶于水,使瓶内气压减小,在大气压的作用下,将塑料瓶压瘪
结论:二氧化碳能溶于水
3.二氧化碳与水的反应
现象:Ⅰ、Ⅱ中纸花不变色,Ⅲ中纸花变为红色,吹干第三朵纸花,纸花由红色变为紫色
分析:水、二氧化碳不能使纸花变色,水和二氧化碳反应生成新酸能使纸花变红,新酸不稳定,易分解。
结论:二氧化碳能与水反应生成碳酸,碳酸不稳定,易分解
二、二氧化碳
1.物理性质
①无色无味气体,密度比空气大,能溶于水
②空气的平均相对分子质量为29 。如果某气体的相对分子质量大于29 ,则这种气体的密度比相同状况下空气的大;如果小于29 ,则其密度比相同状况下空气的小。
2.化学性质
①二氧化碳不能燃烧,也不支持燃烧(二氧化碳用于灭火)
②二氧化与水反应生成碳酸
碳酸不稳定,容易分解成二氧化碳和水
③二氧化碳能使澄清石灰水变浑浊
3.用途
①光合作用的原料;灭火;化工产品的原料;气体肥料
②固态的二氧化碳叫干冰,干冰升华,能吸收大量的热,因此干冰可作制冷剂和人工降雨
三、一氧化碳
1.物理性质
无色无味气体,密度比空气小,难溶于水
2.化学性质
①毒性
一氧化碳极易与血液中的血红蛋白结合,从而使血红蛋白不能再与氧气结合,造成生物体内缺氧,严重时会危及生命。不能用在室内放一盆水,来预防一氧化碳中毒,因为一氧化碳难溶于水。
②可燃性(作燃料):火焰呈蓝色,点燃前需验纯
③还原性(可用于冶金工业)
3.用途
①作燃料
②用于冶金工业
4.二氧化碳与一氧化碳都是由碳元素和氧元素组成的化合物,但其性质差异很大,其原因是它们的分子构成不同