化学方程式
一、化学方程式的意义
1.化学方程式的定义:用____________来表示____________的式子。
2.化学方程式的意义:
(1)化学方程式表示的_________、_________和_________,体现了化学反应中物质转化关系。(质的方面)
(2)化学方程式中各物质的________________(或_______________)等信息,体现了化学反应的定量关系,实际质量比=相对分子质量×化学计量数之比。(量的方面)
(3)化学方程式中的化学计量数,体现了各微粒的粒子数目关系,粒子数目比=化学计量数之比。
(4)举例:
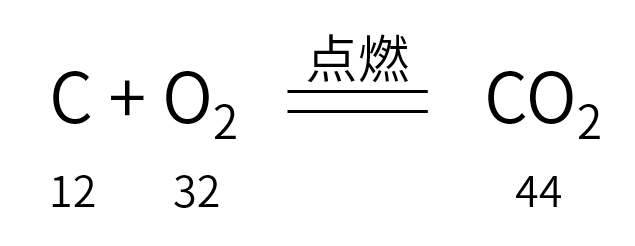
①____________和____________在____________条件下,反应生成____________。
②每_______份质量的碳和_________份质量的氧气完全反应反应,生成_____份质量的二氧化碳。
③每______个碳______和_____个氧______,在____________条件下,反应生成了______个二氧化碳______。
【思考与讨论】
从定性和定量的角度分析以下反应的化学方程式,你能从中获得哪些信息?
(1)
(2)
二、化学方程式的书写
1.化学方程式的书写原则
(1)以____________为基础:写出__________、__________和__________。
(2)遵守质量守恒定律:要根据____________配平化学方程式,使等号两边各原子的____________和____________相等。
2.化学方程式的书写步骤
(1)在式子的左、右两边写出________和_________的化学式,如果反应物或生成物不止一种,就分别用______把它们连接起来;在反应物和生成物之间画一条______,在短线上注明化学反应发生的______,如加热(常用“”号表示)、点燃、催化剂等。
(2)配平化学方程式,检查式子两边各原子的________和_______,通过选取合适的化学计量数,使化学方程式遵守质量守恒定律,将短线改为____________。
(3)气体、沉淀符号的标注
①气体符号:生成物中____________(“有”或“没有”)气体,反应物中____________(“有”或“没有”)气体,则生成物中的气体化学式_________要注_________。
②沉淀符号:对于____________中的反应,如果生成物中____________(“有”或“没有”)固体,而反应物中____________(“有”或“没有”)固体,则生成物中的固体化学式____________要注____________。
【思考与讨论】
(1)实验室和某些供氧器以二氧化住为催化剂,利用过氧化氢分解制取氧气。请写出该反应的化学方程式。
(2)请结合以上反应,思考为什么要配平化学方程式,如何判断化学方程式是否已配平。
三、根据化学方程式进行简单计算
1.利用化学方程式计算的原理
物质间的质量比就是各物质____________与____________乘积的比。
2.利用化学方程式计算的步骤
(1)设未知量
(2)写出反应的____________
(3)在对应化学式下面,写出相关物质的____________与____________的乘积,以及____________、____________
(4)列出比例式,求解
(5)简明地写出答案
3.例题参考书本
必记知识点
一、化学方程式的定义
用化学式表示化学反应的式子
例:
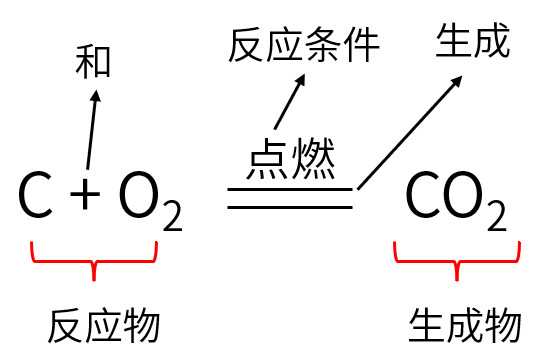
读法:碳和氧气在点燃的条件下生成二氧化碳
二、化学方程式的书写原则
1.必须以客观事实为基础
2.遵守质量守恒定律---保证两边原子数目相等(配平)
三、化学方程式的意义(一看二算)
例:
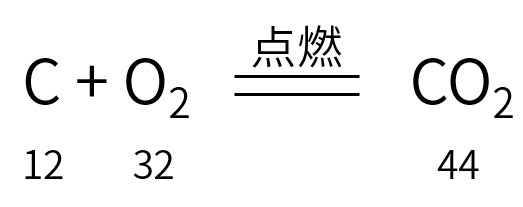
看:反应物、生成物、反应条件
算:反应物、生成物各物质间质量比
读法:碳和氧气在点燃的条件下生成二氧化碳
质量比:12份质量的碳和32份质量的氧气可生成44份质量的二氧化碳
粒子个数比:1个碳原子和1个氧分子可生成1个二氧化碳分子
四、化学方程式的配平
配:化学式前加系数(化学计量数)
平:每种元素两边的原子总数都相等
五、化学方程式书写注意事项
1.化学式书写正确,条件标注正确
2.化学方程式要配平
3.气体沉淀符号标注正确
①生成物有气体,反应物无气体,气体物质化学式右边要注“↑”
②溶液中的反应,生成物有固体,反应物无固体,固体物质化学式右边要注“↓”
4.条件加热用“△”代替
注意区分点燃、加热、高温是三个不同的条件