原子的结构
一、原子的构成
1.原子是由居其中心的___________与___________构成的。原子核一般由________和________构成。每个质子带________________,每个电子带________________,中子不带电荷。
2.由于原子核内质子所带正电荷与核外电子所带负电荷数量________、电性________,所以原子________。可见,原子核所带的正电荷数(________)就等于__________,也等于__________。
二、原子核外电子排布
1.离核近的电子能量较____,离核越远,电子的能量越____。离核最近的电子层为第一层,次之为第二层,依次类推为第三、四、五、六、七层,离核最远的也叫__________,最外层电子数一般不超过____个(只有1 层的,电子数不超过____ 个)。
2.氧原子的结构示意图
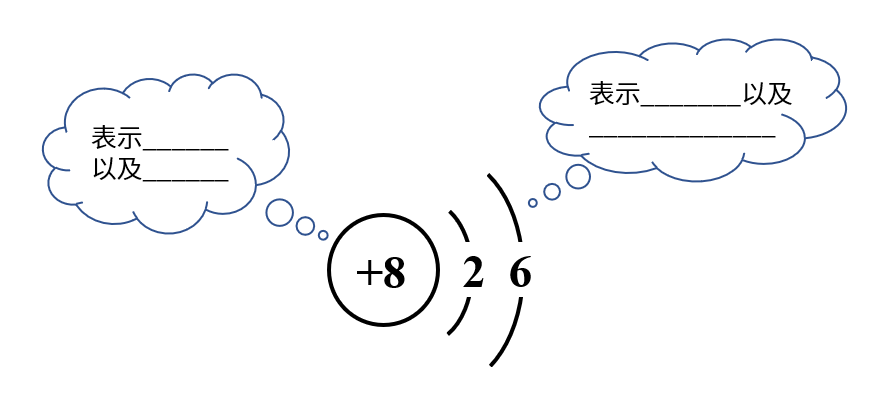
3.稀有气体不易与其他物质发生反应,化学性质比较_______,它们的原子最外层有_______个电子(氦为_____个电子),这样的结构被认为是一种______________。
4.元素的化学性质由_______决定
(1)原子的最外层电子数_______4个,在化学反应中易_______电子,如 _______等非金属原子。
(2)原子的最外层电子数_______4个,在化学反应中易_______电子,如_______等金属原子。
(3)最外层电子数=8,元素化学性质_______,He=2。
三、离子
1.离子的形成
以金属钠与氯气反应为例,钠原子的最外层有_______个电子,氯原子的最外层有_______个电子,当钠与氯气反应时,钠原子最外层的_______个电子转移到氯原子的最外层上,这样两者都形成_______的结构。上述过程中,钠原子失去一个电子而带上_______电荷,氯原子因得到一个电子而带上_______电荷。
2.离子
(1)_____________________的原子叫作离子。
(2)带_______电的原子叫做_______,核电荷数_______(填“>”或“<”或“=”)核外电子数;带_______电的原子叫做_______,核电荷数_______(填“>”或“<”或“=”)核外电子数。
(3)离子也是构成物质的粒子,如:_______。构成物质的粒子:_______、_______、_______。
(4)练习:钠离子:_______,硫离子_______、镁离子_______、氯离子_______。
四、相对原子质量
1.原子质量在书写、使用时十分_______(填“方便”或“不方便”)。
2.相对原子质量
(1)公式:_____________________
(2)相对原子质量_______(填“有”或“没有”)单位,单位是_______。
(3)构成原子的质子、中子的相对质量都约等于_______;与质子、中子相比,电子的质量很_______,整个原子的质量主要集中在_______上。所以,相对原子质量(近似值)=______________+______________。
必记知识点
一、原子的构成
(1)原子的构成
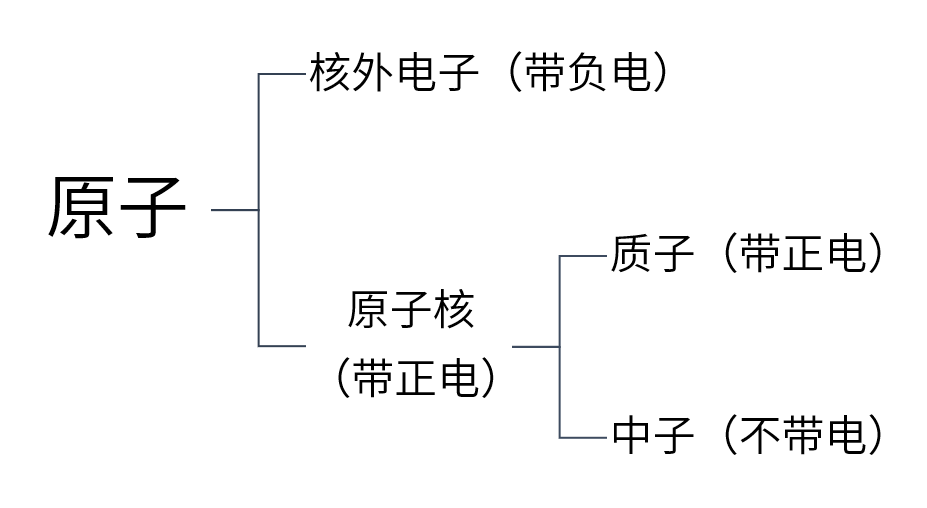
(2)原子内部结构规律
① 不同种类的原子质子数不同
②核电荷数=质子数=电子数=原子序数
③原子不显电性,因为原子核与核外电子所带电荷的电量相等,电性相反
(3)注意
①原子中质子数不一定等于中子数
②并不是所有的原子核中都有中子,氢原子没有中子(中子数为0)
二、原子核外电子排布(核外电子分层排布)
①先近后远,能量由低到高
②电子层(第1-7层)离核最远的叫最外层
③最外层电子数不超过8(只有一个电子层,不超过2)
④每层容纳电子数最多2n2个
三、离子
1.原子最外层电子数的特点
① 稀有气体的原子最外层电子数=8(He=2)(最外层电子数为8个电子的结构称为稳定结构,稳定结构是所有原子的共同愿望)
② 金属的原子最外层电子数<4(化学反应中易失去电子)
③非金属的原子最外层电子数>4(化学反应中易得到电子)
2.离子的概念
①带电的原子或原子团叫离子
②阳离子:带正电的原子叫阳离子
③阴离子:带负电的原子叫阴离子
四、原子和离子的区别与联系
1.原子不带电荷,而离子带电荷
2.离子具有稳定结构,而原子不一定(稀有气体原子具有稳定结构)
3.离子是由原子得失电子而形成的
五、相对原子质量
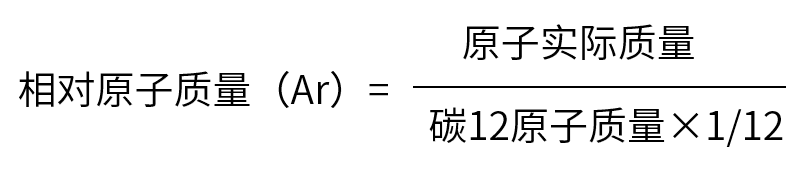
相对原子质量≈质子数+中子数
六、物质的构成
1.构成物质的三种基本微粒:分子、原子、离子
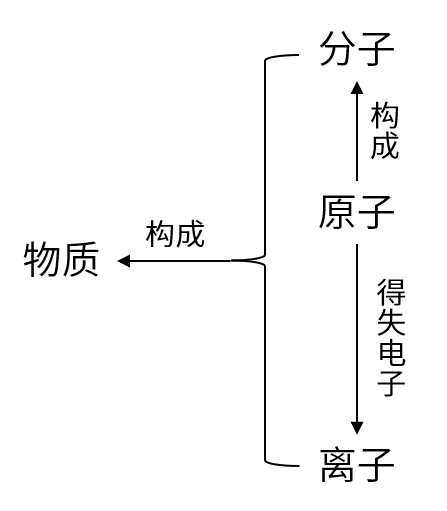
2.举例:
①汞由汞原子构成
②水由水分子构成(1个水分子由两个氢原子和一个氧原子构成)
③氯化钠由钠离子和氯离子构成