一、所含杂质
粗盐中的杂质根据溶解性可分为两大类
难溶性杂质:泥沙等
可溶性杂质:MgCl**2、Na2SO4、CaCl2**等杂质
二、流程图
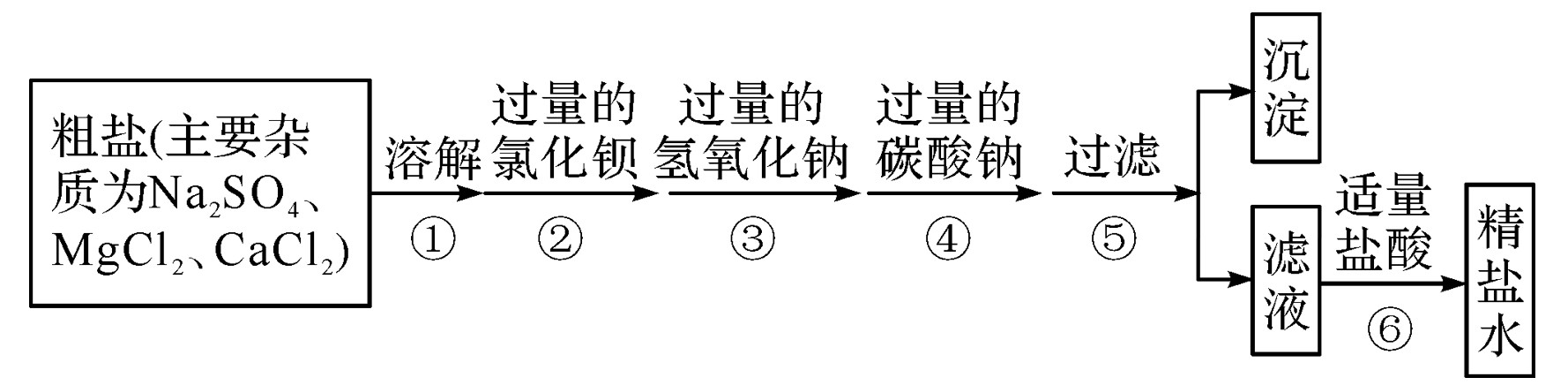
三、杂质的去除
1.难溶性杂质:通过溶解、过滤、蒸发结晶可除去
2.可溶性杂质:需将杂质转变为气体、沉淀、水除去
我们从离子的角度来解决问题
因为我们需要的物质为NaCl,所Na+、Cl-,不算杂质离子,分析MgCl2、Na2SO4、CaCl2的离子构成
杂质离子为Mg**2+** 、SO**42-** 、Ca**2+**
依据常见的气体、沉淀、水除去以上三种离子
(1)Mg2+的去除
可形成Mg(OH)2沉淀,于是我们选择OH-除去Mg2+
阳离子配上Na+(我们需要的离子)
可以选择加入过量的NaOH溶液,除去MgCl2
(2)SO42-的去除
可形成BaSO4沉淀,于是我们选择Ba2+除去SO42-
阴离子配上Cl-(我们需要的离子)
可以选择加入过量的BaCl2溶液除去Na2SO4
(3)Ca2+的去除
可形成CaCO3沉淀,于是我们选择CO32-除去Ca2+
阳离子配上Na+(我们需要的离子)
可以选择加入过量的Na2CO3溶液除去CaCl2
四、过量除杂试剂的去除
为了除尽杂质,我们加入的除杂试剂必须过量
这样会引入新的杂质,同样需要除去
1.简单的分析,加入的Na2CO3可以顺带除去BaCl2
所以Na**2CO3一定要比BaCl2后加入**
2.除去过量的Na2CO3和NaOH
CO32-可用H+、Ba2+、Ca2+除去
OH-可用H+、Cu2+、Fe3+、Mg2+、Al3+除去
综合考虑,可加入稀盐酸,一次性除去Na2CO3和NaOH
3.除去过量的稀盐酸
稀盐酸为HCl气体溶于水,蒸发结晶时可除去,不需要专门除杂
五、除杂的顺序问题
1.因为Na2CO3溶液需要除去过量的BaCl2溶液,所以Na**2CO3溶液一定要比BaCl2溶液后加入**
至于NaOH,在过滤前加入都可行
2.因为稀盐酸会溶解Mg(OH)2、BaCO3、CaCO3,所以加入稀盐酸前需过滤,除去产生的沉淀
六、各种试剂的作用及相关化学方程式
1.NaOH溶液
除去杂质MgCl2
2.BaCl2溶液
除去杂质Na2SO4
3.Na2CO3溶液
除去CaCl2和过量的BaCl2
4.稀盐酸
除去Na2CO3和NaOH