一、如何画原子结构示意图
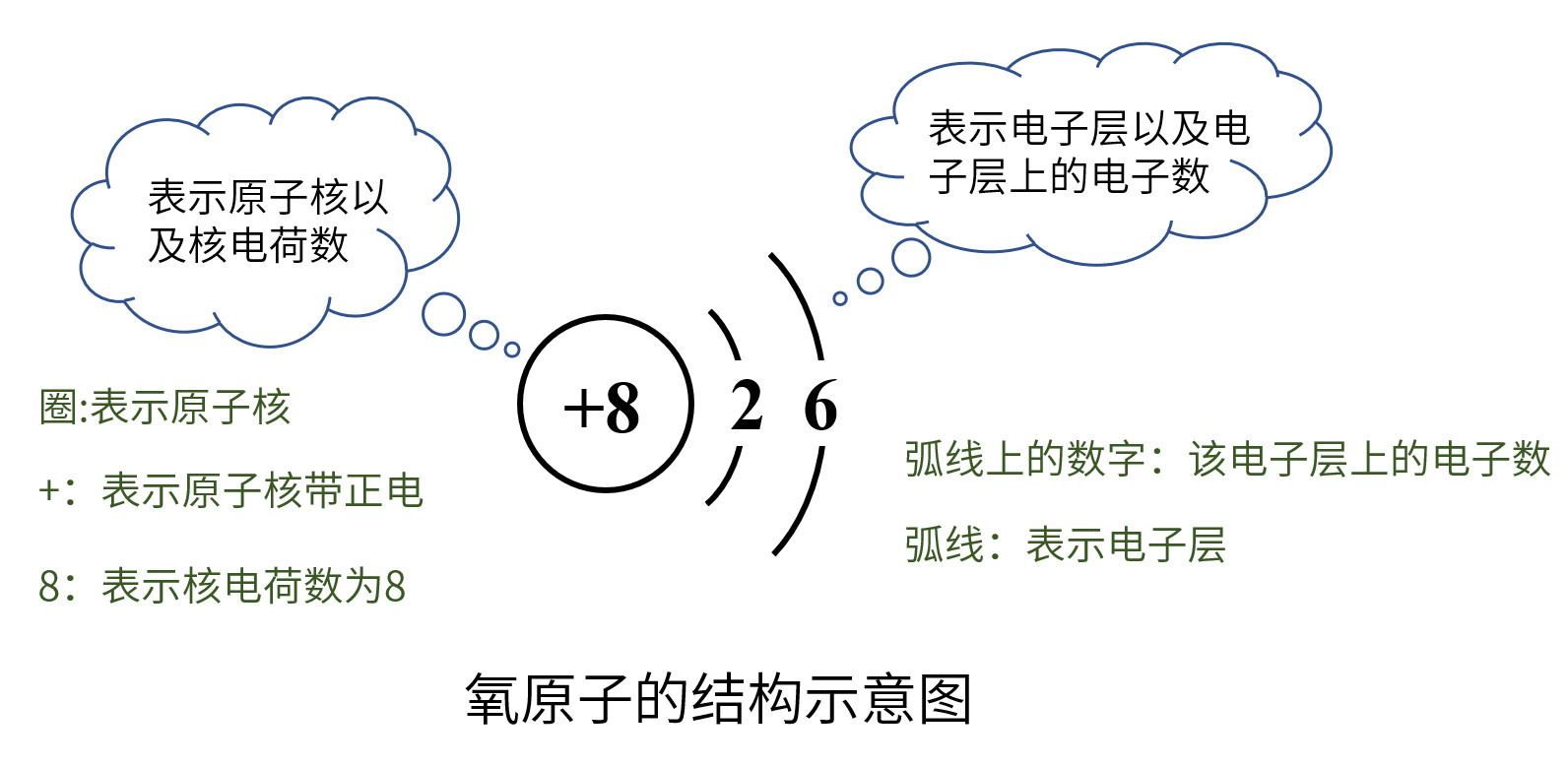
1.原子结构示意图各部分的含义(以氧原子为例)
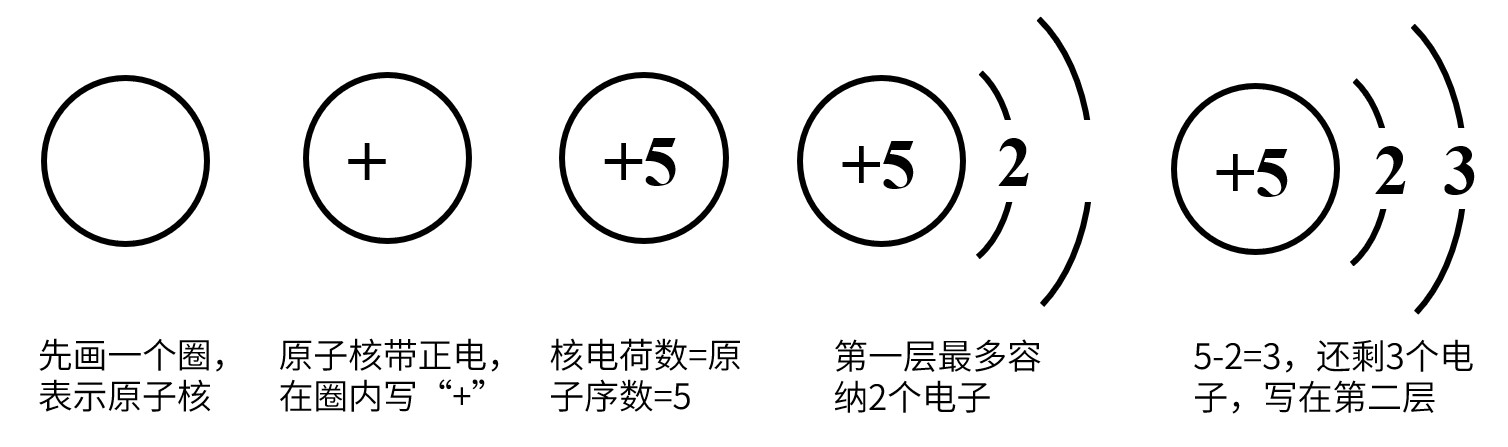
2.原子结构示意图的画法
必备知识
(1)原子核外电子分层排布,排布规律:
①每层最多能容纳的电子数为2n2,最外层电子数不超过八个;
②核外电子先把第一层(可容纳2个电子)排满后,再排第二层(可容纳8个电子),再排第三层(可容纳18个电子) ,以此类推(仅初中适用)
(2)核电荷数=原子序数
画法举例:
①硼原子的原子结构示意图
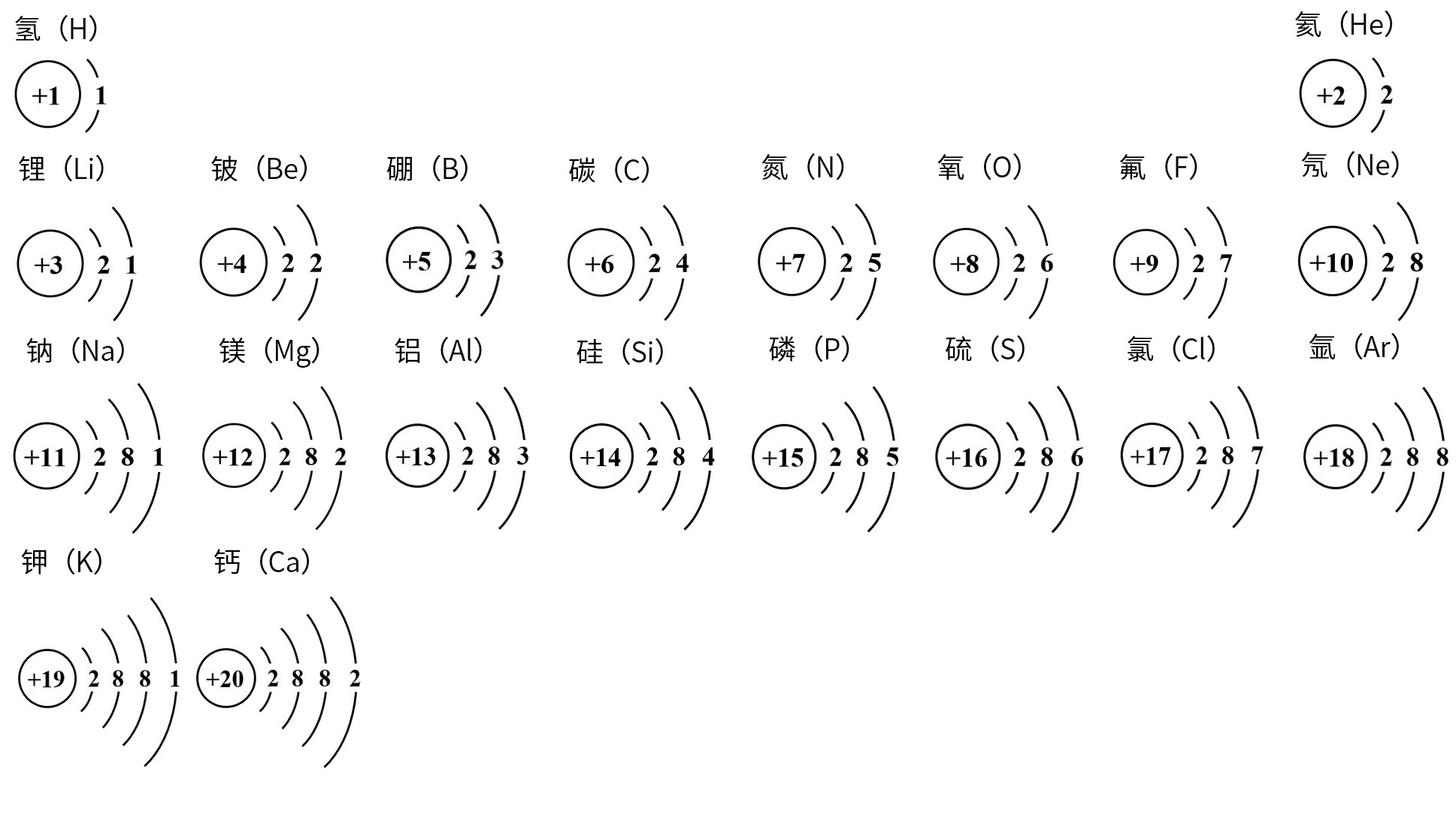
按以上规律画出1-20号元素的原子结构示意图
答案:
二、离子结构示意图(离子符号的书写)
1.必备知识
(1)所有原子都有达到8电子稳定结构的愿望(只有一个电子层,最外层电子数2个为稳定结构)
(2)金属原子通常最外层电子数小于4个,易失去电子;非金属原子最外层电子数通常大于4个,易得到电子;稀有气体原子达到了稳定结构。
(3)离子是原子得失电子达到稳定结构后形成的
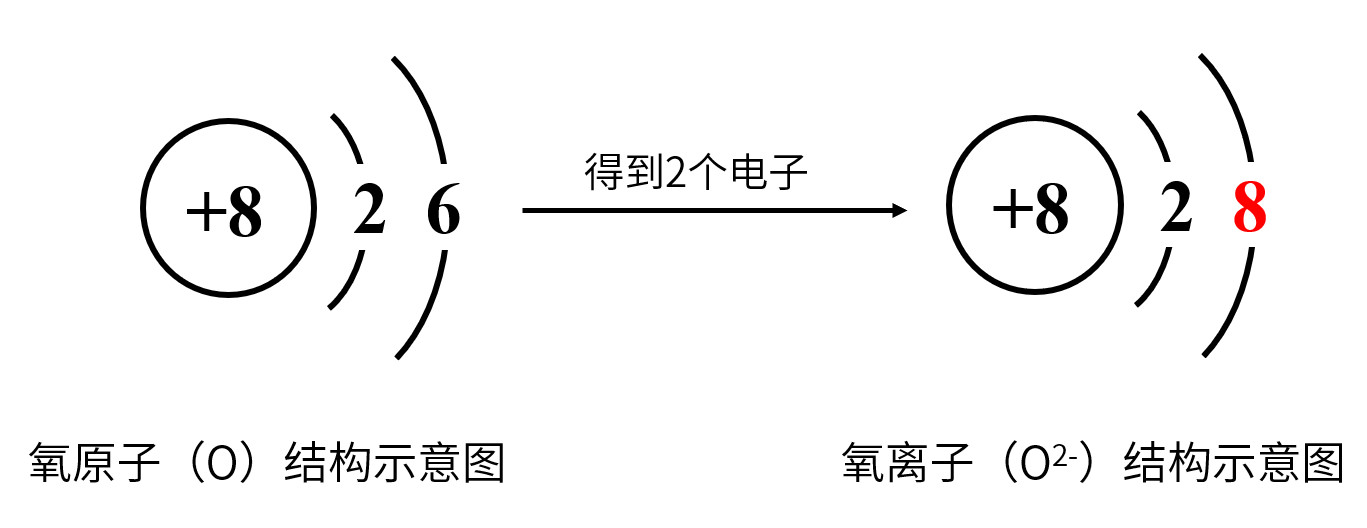
2.离子的形成(以氧离子形成为例)
不具有稳定结构的原子,需要得到或失去电子后,达到稳定结构,于是形成了离子。
3.离子符号的书写
(1)因为电子带负电,得到电子后,离子带负电,为阴离子,得到n个电子带n个单位的负电荷(n-,n=1时省略)。所带电荷情况写在元素符号右上角,如Cl-,S2-
(2)因为电子带负电,失去电子后,离子带正电,为阳离子,失去n个电子带n个单位的正电荷(n+,n=1时省略)。所带电荷情况写在元素符号右上角,Na+,Mg2+
4.离子符号的意义(3Mg2+)
3:3个镁离子
2:1个镁离子带两个单位正电荷(所以写“2+”)
三、根据原子、离子结构示意图写对应符号
1.确定元素符号
原子序数=核电荷数(圆圈内的数字),按原子序数写出元素符号
2.确定所带电荷数
根据核电荷数-核外电子数确定电性(+,-)和所带电荷数
=0为原子;≠0为离子
>0带正电,<0带负电
例子:
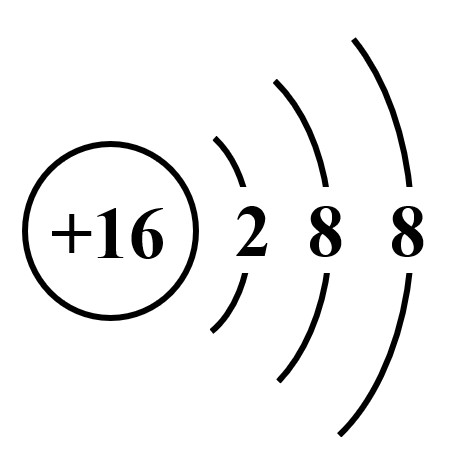
1.原子序数=核电荷数=16,写出硫元素的符号“S”
2.16-18=-2,所以带两个单位负电荷,在S的右上角写“2-"
组合起来为:S2-