一、溶解度曲线必会
1.会查某物质在不同温度时的溶解度
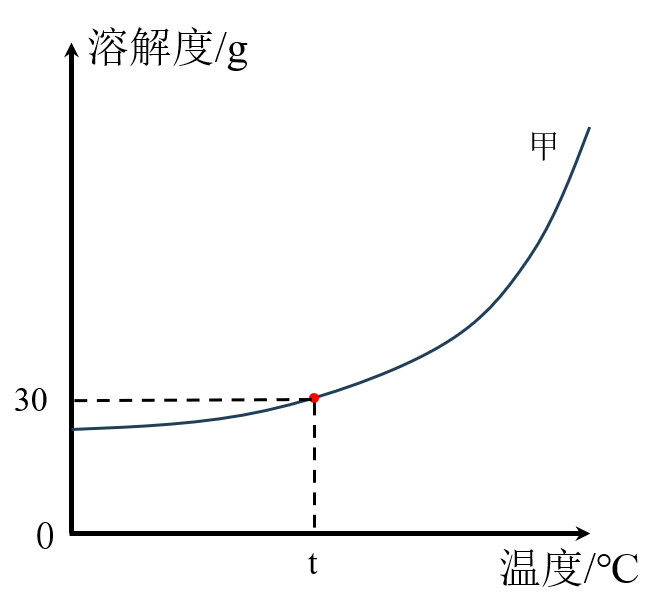
t℃时,甲物质的溶解度为30g
2.会比较不同物质在同一温度时溶解度的大小
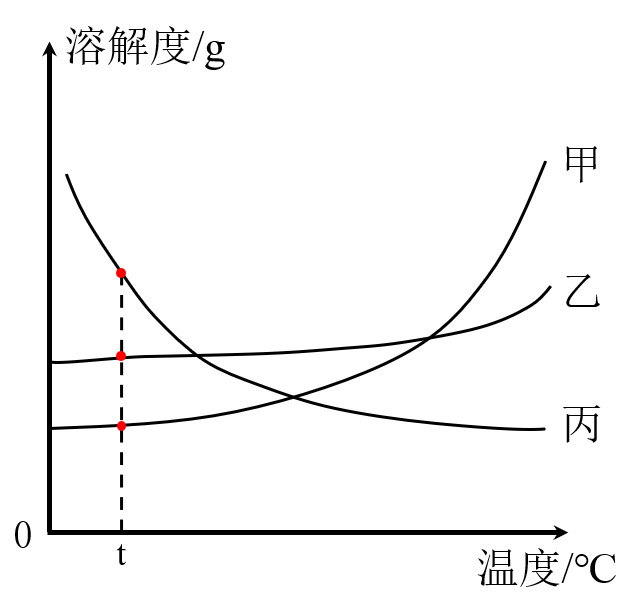
t℃时,溶解度:丙>乙>甲
溶解度曲线相关问题的分析,最终都会转化为比较溶解度大小
3.比较不同物质的溶解度受温度变化影响的大小

甲、丙物质溶解度受温度影响较大
乙物质溶解度受温度影响较小
4.物质的溶解度随温度变化的规律

甲物质溶解度随温度升高而增大(绝大多数物质)
乙物质溶解度受温度影响较小(举例:NaCl)
丙物质溶解度随温度增加,溶解度反而减小(举例:Ca(OH)2)
气体物质溶解度随温度升高而降低,所以丙物质溶解度随温度变化的规律与气体物质溶解度随温度变化的规律相似
二、溶解度曲线中四个点的含义(判断饱和溶液与不饱和溶液)
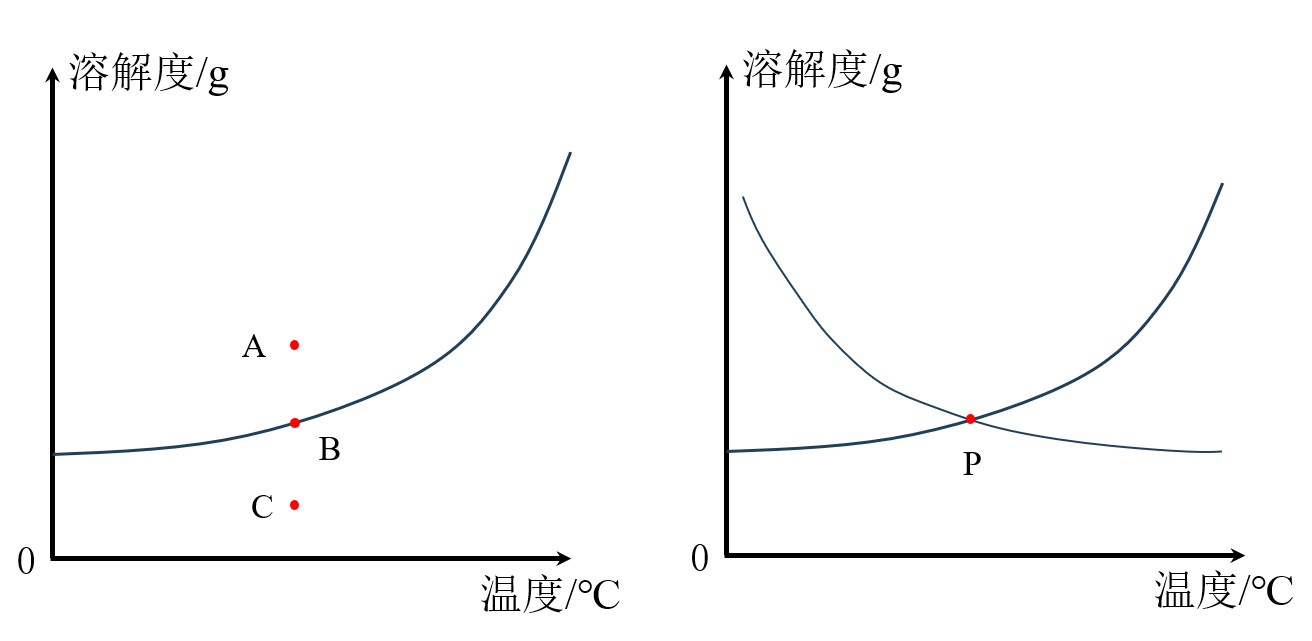
A点(曲线上方的点):过饱和状态,如按照此方法配制溶液,会有固体未溶解;或者会有晶体析出
B点(曲线上的点):恰好饱和
C点(曲线下方的点):不饱和
P点:该温度下,两种物质的溶解度相等
三、溶解度曲线中点的移动(饱和溶液与不饱和溶液的转化)
升温、降温、 增加溶质、增加溶剂、蒸发溶剂在溶解度曲线中的体现
1.升温
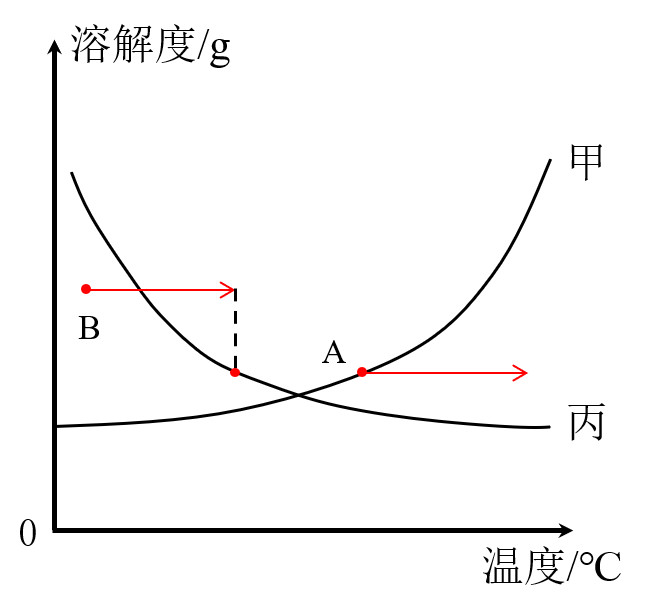
我们首先把溶液的状态在溶解度曲线中标出如A点、B点
升温点会向右移动
对于甲物质,A点在溶解度曲线上,恰好饱和,升温A点跑到溶解度曲线下方,溶液由饱和溶液变成不饱和溶液
对于丙物质,B点在曲线下方,是不饱和溶液,升温B点先到溶解度曲线上,然后到溶解度曲线上方,溶液由不饱和溶液变为恰好饱和,然后变为过饱和溶液,会有晶体析出
小结:
对于溶解度随温度升高而增大的物质(甲),升温能将饱和溶液转变为不饱和溶液
对于溶解度随温度升高而减小的物质(丙),升温能将不饱和溶液转变为饱和溶液,继续升温会有固体析出(结晶)
2.降温
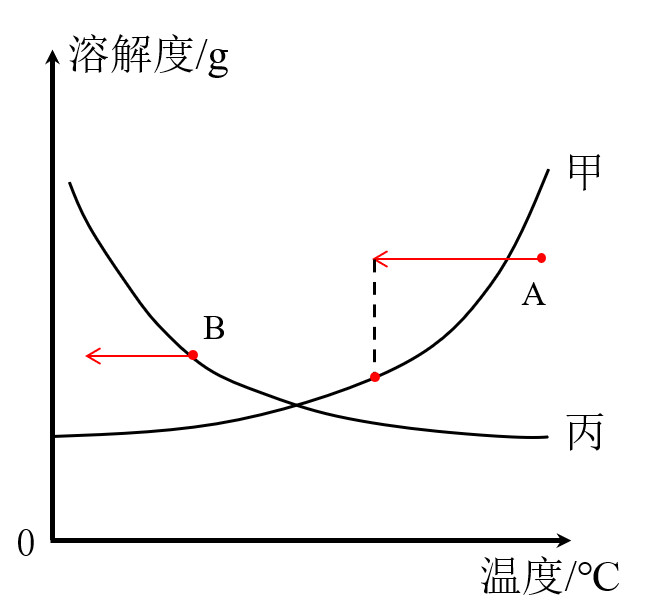
我们首先把溶液的状态在溶解度曲线中标出如A点、B点
降温点会向左移动
对于甲物质,A点在溶解度曲线下方,是不饱和溶液,降温A点跑到溶解度曲线上,然后到溶解度曲线上方,溶液由不饱和溶液变为恰好饱和,然后变为过饱和溶液,会有晶体析出
对于丙物质,B点在曲线上,恰好饱和,降温B点跑到溶解度曲线下方,溶液由饱和溶液变成不饱和溶液
小结:
对于溶解度随温度升高而增大的物质(甲),降温能将不饱和溶液转变为饱和溶液,继续降温会有固体析出(结晶)
对于溶解度随温度升高而减小的物质(丙),降温能将饱和溶液转变为不饱和溶液
3.增加溶质或蒸发溶剂
增加溶质或蒸发溶剂点向上移动
对于物质甲、丙,A点在曲线下方,是不饱和溶液,增加溶质或蒸发溶剂点会跑到曲线上方
对于增加溶质,溶液由不饱和溶液变为恰好饱和,继续增加溶质,会有固体未溶解
对于蒸发溶剂,溶液由不饱和溶液变为恰好饱和,然后变为过饱和溶液,会有晶体析出
小结:增加溶质或蒸发溶剂能使溶液由不饱和溶液变为饱和溶液,蒸发溶剂还能使溶液变为过饱和溶液,会有晶体析出(结晶)
4.增加溶剂
增加溶剂点向下移动
对于物质甲、丙,A、B点均在溶解度曲线上,恰好饱和,增加溶剂点跑到溶解度曲线下方,溶液由饱和溶液变为不饱和溶液
小结:增加溶剂,溶液会由饱和溶液变为不饱和溶液
总结:
饱和溶液转变为不饱和溶液:增加溶剂、对于溶解度随温度升高而增大的物质可以升高温度;对于溶解度随温度升高而降低的物质可以降低温度
不饱和溶液转变为饱和溶液:增加溶质、蒸发溶剂、对于溶解度随温度升高而增大的物质可以降低温度;对于溶解度随温度升高而降低的物质可以升高温度
结晶方法:蒸发结晶、降温(升温)结晶
四、结晶方法的选择
结晶方法有蒸发结晶和降温结晶
提纯溶解度受温度影响大的物质:降温结晶
提纯溶解度受温度影响小的物质:蒸发结晶