在溶解度曲线中,任何量的比较,最后都转化成比较溶解度的大小,因为从溶解度曲线中,只能看到溶解度
一、溶解度曲线基本知识
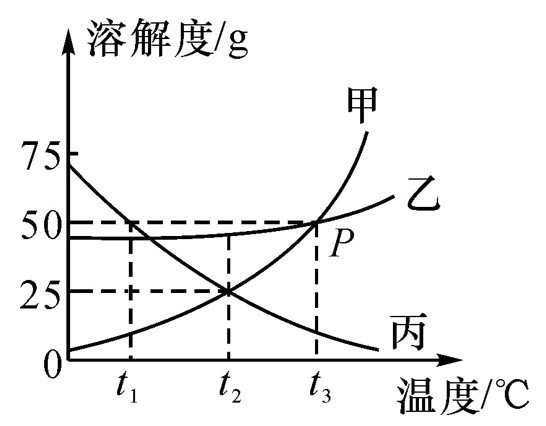
1.查某温度下,物质的溶解度
t1℃时,丙物质的溶解度为:50g
2.比较某温度下,物质溶解度的大小
t1℃时,甲、乙、丙溶解度大小:甲<乙<丙
3.计算某温度下,一定量溶剂最多溶解物质的质量
t1℃时,50g水最多能溶解丙物质的质量:25g
=
4.判断溶液是否饱和,及计算溶液的质量
首先计算该温度下,一定量溶剂最多溶解物质的质量
t1℃时,50g水最多能溶解丙物质的质量:25g
t1℃时,将15g丙物质加入到50g水中,得到不饱和溶液,所得溶液质量为65g
t1℃时,将25g丙物质加入到50g水中,得到饱和溶液(恰好饱和) ,所得溶液质量为75g
t1℃时,将35g丙物质加入到50g水中,得到饱和溶液,所得溶液质量为75g
5.饱和溶液与不饱和溶液的转换
饱和溶液转变为不饱和溶液:增加溶剂、对于溶解度随温度升高而增大的物质可以升高温度;对于溶解度随温度升高而降低的物质可以降低温度
不饱和溶液转变为饱和溶液:增加溶质、蒸发溶剂、对于溶解度随温度升高而增大的物质可以降低温度;对于溶解度随温度升高而降低的物质可以升高温度
6.结晶方法的选择
结晶方法有蒸发结晶和降温结晶
提纯溶解度受温度影响大的物质:降温结晶
提纯溶解度受温度影响小的物质:蒸发结晶
二、比较溶液、溶质、溶剂的质量
1.一定温度下、等质量的饱和溶液
溶解度越大,溶质质量越大,溶剂质量越小
2.一定温度下、等质量的溶质
溶解度越大,溶剂质量越小,溶液质量越小
3.一定温度下、等质量的溶剂
溶解度越大,溶质质量越大,溶液质量越大
三、比较饱和溶液溶质的质量分数
饱和溶液溶质的质量分数=×100%
可以看出溶解度越大,饱和溶液溶质的质量分数越大
四、温度改变时,饱和溶液中溶液质量、溶质质量、溶剂质量的变化
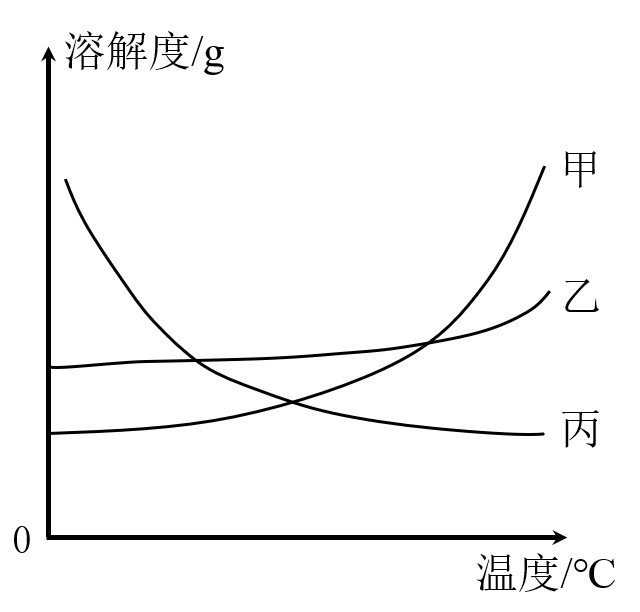
1.对于甲和乙,溶解度随温度升高而增大
(1)升温
无晶体析出,溶质质量不变,溶剂质量不变,溶液质量不变,溶质质量分数不变
(2)降温
有晶体析出,溶质质量减小,溶剂质量不变,溶液质量减小,溶质质量分数减小
2.对于丙,溶解度随温度升高而降低
(1)升温
有晶体析出,溶质质量减小,溶剂质量不变,溶液质量减小,溶质质量分数减小
(2)降温
无晶体析出,溶质质量不变,溶剂质量不变,溶液质量不变,溶质质量分数不变
五、比较析出晶体的质量
等质量各物质的饱和溶液,在温度变化相同时,溶解度曲线越陡,析出晶体的质量越多
六、几点注意事项
忽略温度,比较溶解度是没有意义的
没有强调溶液是饱和溶液,去比较析出晶体的质量或利用溶解度去解决问题是没有意义的
对质量没有加以限定,比较溶液质量、溶质质量、溶剂质量、析出晶体的质量是没有意义的