新教材中测定空气中氧气含量由实验改为思考与讨论,重点掌握实验的原理,要求有所降低,但练习仍被当作重点,还是应尽量掌握
一、装置图
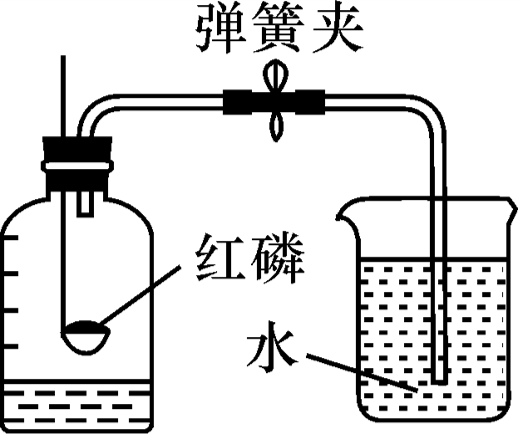
二、实验原理
红磷燃烧,消耗空气的中的氧气,使集气瓶内压强降低,在大气压的作用下将烧杯内的水压入集气瓶,进入水的体积等于消耗氧气的体积
三、文字、符号表达式、化学方程式
四、实验操作
1.检查装置气密性
2.在集气瓶中装少量水,并将水面上方空间分为5等份
3.用弹簧夹夹紧胶皮管
4.点燃燃烧匙中的红磷,立即伸入瓶中并把塞子紧塞紧
5.待红磷熄灭并冷却后,打开弹簧夹。
五、实验现象
放热、产生大量白烟;冷却至室温,打开弹簧夹,烧杯中的水经导管进入集气瓶,进入水的体积约占瓶内空气体积的 1/5
六、实验结论
空气中氧气的体积约占空气体积的 1/5
七、误差分析
分析方法:瓶中的气压越低,压入的水越多,结果偏大;瓶中的气压越大,压入的水越少,结果偏小。
1.小于1/5
(1)装置漏气
分析:漏气会有气体进入集气瓶,平衡气压,使吸入的水减少,结果偏小
(2)红磷的量不足
分析:红磷的量不足,不能消耗完氧气,瓶内气压偏大,结果偏小
(3)未冷却到室温就打开弹簧夹
分析:未冷却到室温,温度高,气体受热膨胀,气压偏大,结果偏小
(4)部分水残留在导管中,未进入集气瓶
分析:水残留在导管中,没有进入集气瓶,明显水少了,结果偏小
2.大于1/5
(1)弹簧夹没有夹紧
分析:红磷燃烧时集气瓶内气体受热膨胀,会顺着导管逸出,气压偏小,结果偏大
(2)燃烧匙伸入过慢
分析:使装置内气体受热膨胀,从集气瓶口逸出,气压偏小,结果偏大
八、剩余气体(N2)性质的探究
1.将燃着的木条伸入集气瓶中,会发现燃着的木条熄灭,说明剩余气体不能燃烧也不支持燃烧
2.吸入水的体积约占集气瓶中空气体积的1/5,也能说明剩余气体难溶于水,因为若剩余气体溶于水,气压会降低,会将更多的压入集气瓶
九、瓶中水的作用
1.吸收五氧化二磷,防止污染空气
2.吸收热量,加速冷却,缩短冷却时间
3.防止高温熔融物溅落,使集气瓶底炸裂(部分老师不赞成这一点,大家自己选择)
十、药品选择依据
分析:
镁条在空气中燃烧会与空气中的氮气反应,导致消耗的气体变多,导致结果偏大,所以不能选择镁条作为药品;木炭在空气中燃烧会生成二氧化碳气体,导致集气瓶内气压几乎不变,不会有水进入集气瓶,所以不能选择木炭作为药品。
药品选择依据:
1.只与空气中氧气反应,不与空气中的其他成分反应
2.反应后生成物不能是气体