第一单元 走进化学世界
1. 没有生成新物质 的变化叫作物理变化, 生成新物质 的变化叫化学变化,又叫作化学反应。物质不需要发生化学变化就表现出来的性质叫作物理性质,物质在化学变化中表现出来的性质叫作化学性质。通过 “能”、“易”、“难”、“可以”、“会” 等关键词区分性质和用途。
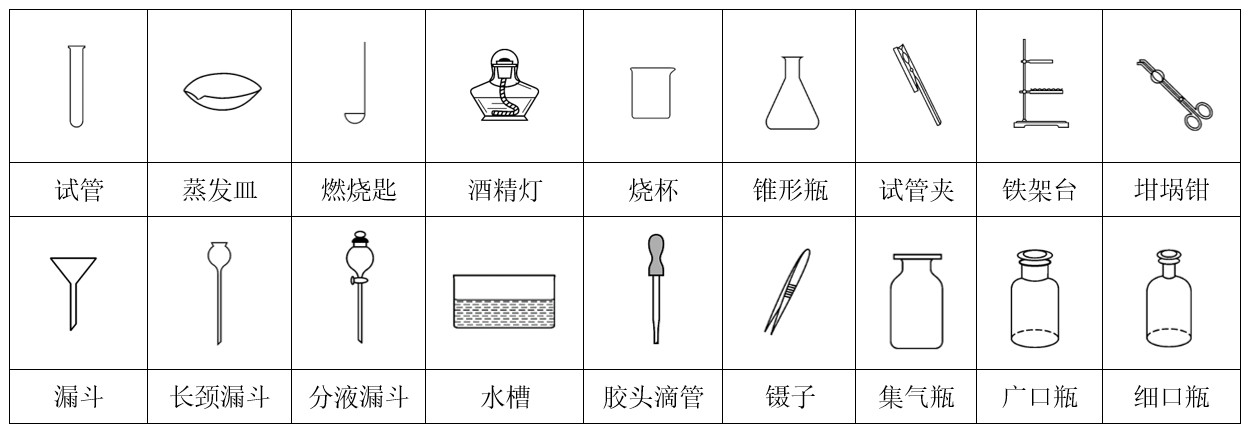
2.认识下列仪器
1. 没有生成新物质 的变化叫作物理变化, 生成新物质 的变化叫化学变化,又叫作化学反应。物质不需要发生化学变化就表现出来的性质叫作物理性质,物质在化学变化中表现出来的性质叫作化学性质。通过 “能”、“易”、“难”、“可以”、“会” 等关键词区分性质和用途。
2.认识下列仪器

1.常见的酸
| 盐酸(HCl) | 硫酸(H2SO4) | |
|---|---|---|
| 物理性质 | 1.无色、有刺激性气味的液体 2.浓盐酸具有挥发性 |
1.无色、无味、黏稠的油状液体 2.浓硫酸具有吸水性 |
| 化学性质(特性) | 腐蚀性(脱水性) | |
| 敞口放置 | 溶质质量减小溶剂质量不变溶液质量减小 溶质质量分数减小 | 溶质质量不变溶剂质量增大溶液质量增大 溶质质量分数减小 |
| 用途 | 1.重要的化工产品 2. 金属表面除锈 、制造药物等 3.人体 胃液 中含有盐酸,可帮助消化 |
1.重要的化工原料 2.用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和 金属除锈 |
| 化学性质 | 1.与指示剂作用 2. 与活泼金属反应 3. 与金属氧化物反应 4. 与碱反应 5. 与盐反应 |
1.人类所需营养素有 蛋白质 、 糖类 、 油脂 、 维生素 、 无机盐 、 水 六大类。糖类[淀粉:(C6H10O5)n、葡萄糖:C6H12O6],人体主要的供能物质。蛋白质:食物中的蛋白质在消化道与水反应生成氨基酸一部分氨基酸重新形成人体所需要的多种蛋白质,促进生长发育另一部分氨基酸被氧化生成尿素、二氧化碳、水,同时放出能量。油脂是油和脂肪的合称,脂肪是重要的备用能源。
1.空气的成分
按 体积 计算,氮气:78%、氧气:21%、稀有气体:0.94%、二氧化碳:0.03%、其他气体和杂质:0.03%。
2.氧气: 供给呼吸 (动植物呼吸、医疗急救); 支持燃烧 (炼钢、气割、气焊、航天航空)
3.氮气:
性质:无色、无味、气体,不易溶于水,不能燃烧、也不支持燃烧(化学性质 不活泼 )
用途:重要的化工原料(制硝酸、氮肥);保护气(焊接金属、食品包装);液氮冷冻麻醉
4.稀有气体(惰性气体)
性质:无色无味的气体;化学性质 很不活泼
用途:作保护气;作电光源;氦气制造低温环境
1.构成物质的微粒: 分子 、 原子 、 离子 。
2.微粒的特性:分子的体积质量小, 分子总在不断运动 (温度越高分子运动速率越快), 分子之间有间隔 (固<液<气)。
3.化学反应的实质: 分子分成原子,原子重新组合成新的分子 。
4.分子:分子是保持物质化学性质的最小粒子(由分子构成的物质)。
5.原子:原子是化学变化中的最小粒子。
6.分子和原子的区别与联系
区别:在化学变化中,分子 可分 ,而原子 不能再分 ;联系:分子由原子构成
1.水净化的方法:沉降、 过滤 、吸附(活性炭吸附,除去色素异味有害气体)、蒸馏(得到纯净物的水)
2.沉淀、过滤除去不可溶性杂质,吸附、蒸馏能除去可溶性杂质,均为 物理 变化
3.硬水: 含较多 可溶性钙、镁化合物的水;软水: 不含或含较少 可溶性钙、镁化合物的水
4.氢气物理性质:无色无味气体,密度比空气小,难溶于水。
5.氢气化学性质:可燃性(点燃前需要 验纯 ,火焰呈 淡蓝色 )。
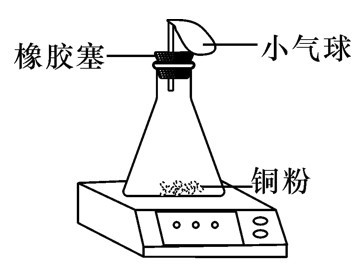
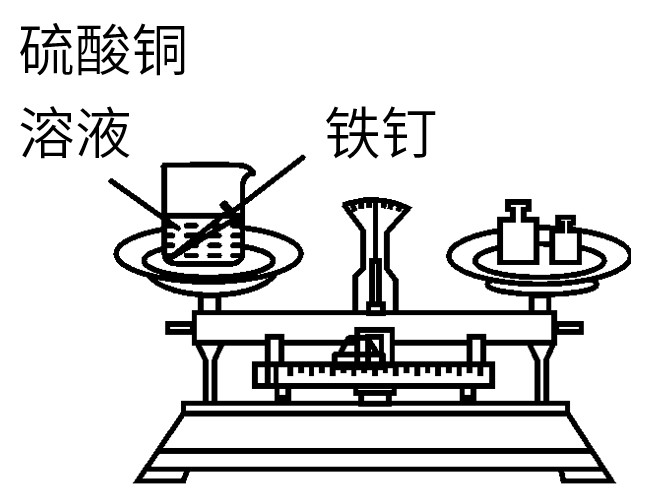
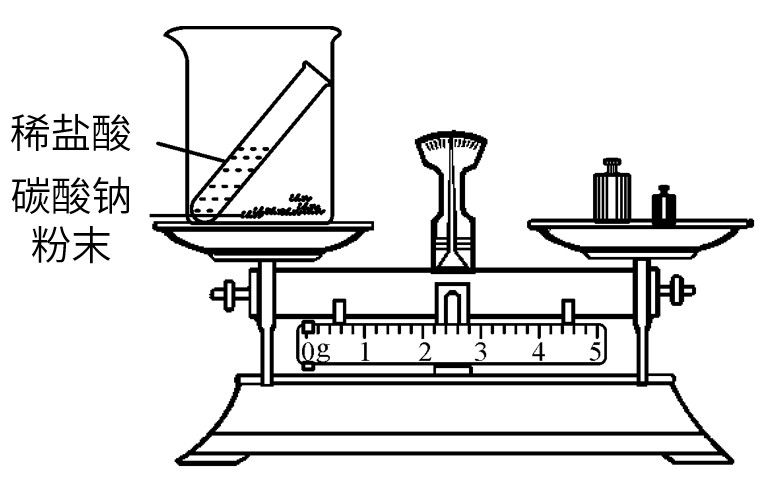
1.质量守恒定律的验证
 |
 |
 |
 |
|---|---|---|---|
| 现象: 红色粉末逐渐变为黑色,气球先膨胀后变瘪 ,天平 平衡 | 现象: 铁钉表面有红色物质生成,溶液由蓝色变为浅绿色 ,天平 平衡 | 现象: 烧杯中产生大量气泡 ,天平 不平衡 | 现象: 镁条燃烧,发出耀眼的白光,产生大量白烟,生成白色固体 ,天平 不平衡 |
| 可用于验证质量守衡定律 |
不可用于验证质量守恒定律 |
||
| 都遵守质量守恒定律 | |||
| 橡胶塞的作用: 形成密闭环境 ;小气球的作用: 平衡气压,防止橡胶塞冲出 | - | 生成CO2逸散到空气中造成反应前后质量不等 | 有氧气参与反应和白烟逸散到空气中造成反应前后质量不等 |
| 对于有气体参与或生成的反应,验证质量守恒定律,应在 密闭环境 中进行 |
1.碳和碳的氧化物性质对比
| 碳单质 | 碳的氧化物 | |||||
|---|---|---|---|---|---|---|
| 物质 | 金刚石 | 石墨 | C₆₀ | 活性炭 | CO | CO₂ |
| 物理性质 | 1.无色透明的固体 2.天然存在的最硬的物质 3.金刚石薄膜透光性好,硬度大,导热性好 |
1.灰黑色有金属光泽 2.石墨很软有滑腻感 3.优良的导电性 |
(1个C₆₀分子由60个碳原子构成) | 吸附性(物理性质) | 1.无色无味气体 2.密度比空气小 3.难溶于水 |
1. 无色无味气体 2.密度比空气大 3.能溶于水 |
| 化学性质 | 1.常温下,碳的化学性质 不活泼 2.可燃性(充分燃烧、不充分燃烧) 3.还原性 |
1. 毒性 2. 可燃性 3.还原性 |
1. 不能燃烧也不支持燃烧 2.能与水反应 3.能与碱反应 4.与碳反应 |
|||
| 用途 | 作装饰品、钻头、裁玻璃、切割大理石、加工坚硬金属作透镜等光学仪器的涂层可用于集成电路基板散热 | 铅笔芯、电极、电刷 | 能广泛应用于超导、催化、材料、医学及生物等领域 | 作吸附剂 | 1.作燃料(可燃性) 2.冶炼金属(还原性) |
1. 灭火 2.光合作用的原料 3作气体肥料 |
| 性质比较 | 物理性质差异大: 碳原子排列方式不同 化学性质相似:都是由碳元素组成的单质 |
性质差异大: 分子构成不同 |
1.燃烧条件: 可燃物 ; 氧气(或空气) ;温度达到 着火点 。
2.灭火的原理: 清除或隔离可燃物 ; 隔绝氧气(或空气) ; 使温度降低到着火点以下 。
3.二氧化碳灭火器:图书、档案、精密仪器等引起的火灾。
4.可燃性气体等在空气中达到一定的含量时,遇到火源就会发生爆炸。
5.氧化钙与水反应放热。
6.石油的综合利用:根据石油中各成分沸点的不同分离出各种产品-分馏( 物理 变化)。
1.金属材料包括 纯金属 以及 合金 。年产量: 铁、铝、铜 ,使用先后顺序: 铜、铁、铝 。金属铜呈 紫红色 ,铁粉为 黑色 ,汞是 液体 。
2.合金:在金属中加热熔合某些 金属 (或 非金属 )形成的具有金属特性的混合物。合金中至少含 一 种金属。
3.铝抗腐蚀性好的原因是: 与氧气反应生成致密的氧化铝薄膜,防止内层的铝进一步被氧化 。