知识清单
一、常见的酸
1.常见的酸
盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、醋酸(CH**3COOH**)、柠檬酸
2.盐酸(HCl气体溶于水形成的溶液)
(1)性质:
①无色有刺激性气味的液体
②挥发性:打开试剂瓶口能观察到白雾(挥发的HCl溶解于水蒸气形成的小液滴)
(2)用途:
①用于金属表面除锈
②胃酸的主要成份,可以帮助消化
3.硫酸
(1)性质:
①无色无味的液体
②强烈的腐蚀性(脱水性)
③吸水性-做干燥剂
(2)用途:
①金属除锈
②做干燥剂
(3)浓硫酸的稀释
将浓硫酸沿烧杯壁缓慢的注入盛有水的烧杯里,用玻璃棒不断搅拌
口诀:酸入水
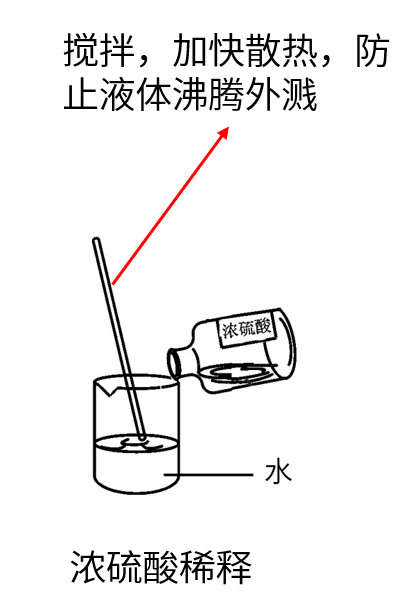
注意:浓硫酸酸沾到皮肤或衣物,用大量水冲洗,涂上3%~5%的碳酸氢钠溶液
4.浓盐酸敞口放置:溶质质量减小,溶剂质量不变,溶质质量分数减小(挥发性)
5.浓硫酸敞口放置:溶质质量不变,溶剂质量增大,溶质质量分数减小(吸水性)
二、酸的化学性质
1.与指示剂作用
酸能使紫色石蕊溶液变红,不能使无色酚酞溶液变色
2.与活泼金属反应
酸 + 活泼金属 → 盐 + H2
3.与金属氧化物反应
现象:铁锈逐渐溶解,溶液由无色变为黄色
现象:铁锈逐渐溶解,溶液由无色变为黄色
酸 + 金属氧化物 → 盐 + 水
4.与碱反应
酸 + 碱 → 盐 + 水
5.与盐反应
现象:有大量气泡产生
现象:有白色沉淀生成
现象:有白色沉淀生成
酸 + 盐 → 盐 + 酸
三、复分解反应
由两种化合物相互交换成分,生成另外两种化合物的反应
特点:价不变,互交换
通式:AB+CD=AD+CB
四、常见的碱
1.常见的碱
氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH**3 ·H2O**)
2.氢氧化钠(NaOH)
(1)俗名:火碱、烧碱、苛性钠
(2)性质:
①白色块状固体
②易潮解(容易吸收水分,表面潮湿并逐渐溶解)-作干燥剂
③溶于水放热
④强腐蚀性
注意:如NaOH不慎沾到皮肤上,用大量水冲洗,涂上硼酸溶液
(3)用途:
①干燥剂
②制取肥皂、以及石油、造纸、纺织和印染等工业
③除油污(氢氧化钠能与油脂发生化学反应)
去油污三兄弟:洗涤剂(乳化现象)、汽油(溶解形成溶液)、氢氧化钠(化学反应),新教材删去了乳化现象,思考了一会,还是放在这里
3.氢氧化钙[Ca(OH)2]
(1)俗名:熟石灰、消石灰
(2)性质:
①白色粉末状固体
②微溶于水(水溶液:石灰水;有较多氢氧化钙未溶解:石灰乳、石灰浆)
(3)用途:
①作建筑材料
②含硫磺粉的石灰浆,可保护树木,防冻、防虫
③配制成有杀菌作用的波尔多液(硫酸铜和氢氧化钙)
④改良酸性土壤(不能用NaOH)
制取:
五、碱的化学性质
1.与指示剂作用
碱能使紫色石蕊溶液变蓝,使无色酚酞溶液变红
2.与非金属氧化物反应
吸收二氧化碳:
检验二氧化碳:
现象:澄清石灰水变浑浊
碱 + 非金属氧化物 → 盐 + 水
3.与酸反应
碱 + 酸 → 盐 + 水
4.与盐反应
现象:有蓝色絮状沉淀生成
现象:有红褐色沉淀生成
现象:有白色沉淀生成
碱 + 盐 → 盐 + 碱
六、酸、碱具有相似化学性质的原因
1.酸具有通性的原因:在水中都会解离出H +
2.碱具有通性的原因:在水中都会解离出OH -
七、中和反应
1.什么是酸碱盐
酸:在水中解离的阳离子只有H+的化合物
碱:在水中解离的阴离子只有OH-的化合物
盐:金属离子(或铵根离子)与酸根离子构成的化合物
2.概念:酸与碱作用生成盐和水的反应,叫做中和反应
3.中和反应的实质:氢离子和氢氧根离子结合生成水分子
H + + OH - =H2O
4.实验
(1)步骤:在烧杯中加入约5ml氢氧化钠溶液,滴入几滴酚酞溶液,用滴管缓慢的滴入稀盐酸,并不断搅拌溶液,至溶液恰好变为无色
(2)解释:稀盐酸和氢氧化钠溶液反应,无明显的现象。通过滴加酚酞溶液来证明确实发生了化学反应。因为氢氧化钠溶液能使酚酞溶液变红,但是滴加稀盐酸后,红色消失了,证明氢氧化钠消失了,转变为了其他物质,以此证明氢氧化钠和稀盐酸确实发生化学反应。我们在证明两种物质发生了化学反应时,除了可以证明有新物质生成,还可以通过证明反应物消失了来证明化学反应的发生
5.中和反应举例
6.中和反应在实际中的应用
①治疗胃酸(盐酸)过多
②蚊虫叮咬,分泌蚁酸,涂抹碱性(肥皂水)物质,减轻痛痒
③利用中和反应处理工厂废水
④利用中和反应,调节土壤的酸碱性