知识清单
一、饱和溶液
1.概念
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液;还能继续溶解的溶液,叫做这种溶质的不饱和溶液
2.概念的理解
(1)改变溶剂量和温度,都能改变溶解物质的多少,因此只有在一定温度下、一定量溶剂里,谈饱和溶液,不饱和溶液才有意义
(2)这种溶质的饱和溶液的理解:饱和的氯化钠溶液还能溶解少量硝酸钾,对于氯化钠而言是饱和溶液,而对于硝酸钾而言是不饱和溶液,所以是这种溶质的饱和溶液
3.饱和溶液与不饱和溶液的判断
(1)若某种固体未溶解,对于这种物质而言一定是饱和溶液
(2)若无固体未溶解,则存在两种状态,分别为不饱和溶液和恰好饱和
我们可以加入少量该溶质,如果溶解,是不饱和溶液;如果没有溶解,是饱和溶液
或者蒸发少量溶剂,如果没有固体析出,是不饱和溶液;如果有固体析出,是饱和溶液
4.饱和溶液与不饱和溶液的转换
饱和溶液转化为不饱和溶液:升高温度、增加溶剂
不饱和溶液转变为饱和溶液:增加溶质、降低温度、蒸发溶剂
注意:这里的改变温度不一定靠谱,需根据溶解度曲线具体判断
二、结晶
1.概念
溶质从溶液中以晶体的形式析出,这一过程叫做结晶
2.结晶方法
降温结晶、蒸发结晶
三、固体溶解度
1.概念
在一定温度下,某固体物质在100g溶剂里达到饱和状态时,所溶解的质量
2.四要素
温度:不指定温度,谈溶解度是没有意义的
溶剂量:100g
饱和状态:要溶解到不能溶解为止
单位:g
3.举例:20℃时氯化钠的溶解度为36g
意义:
20℃ ,氯化钠在100g水中,达到饱和状态,溶解的质量为36g
20℃ ,100g水中,最多只能溶解36g氯化钠
四、溶解度曲线
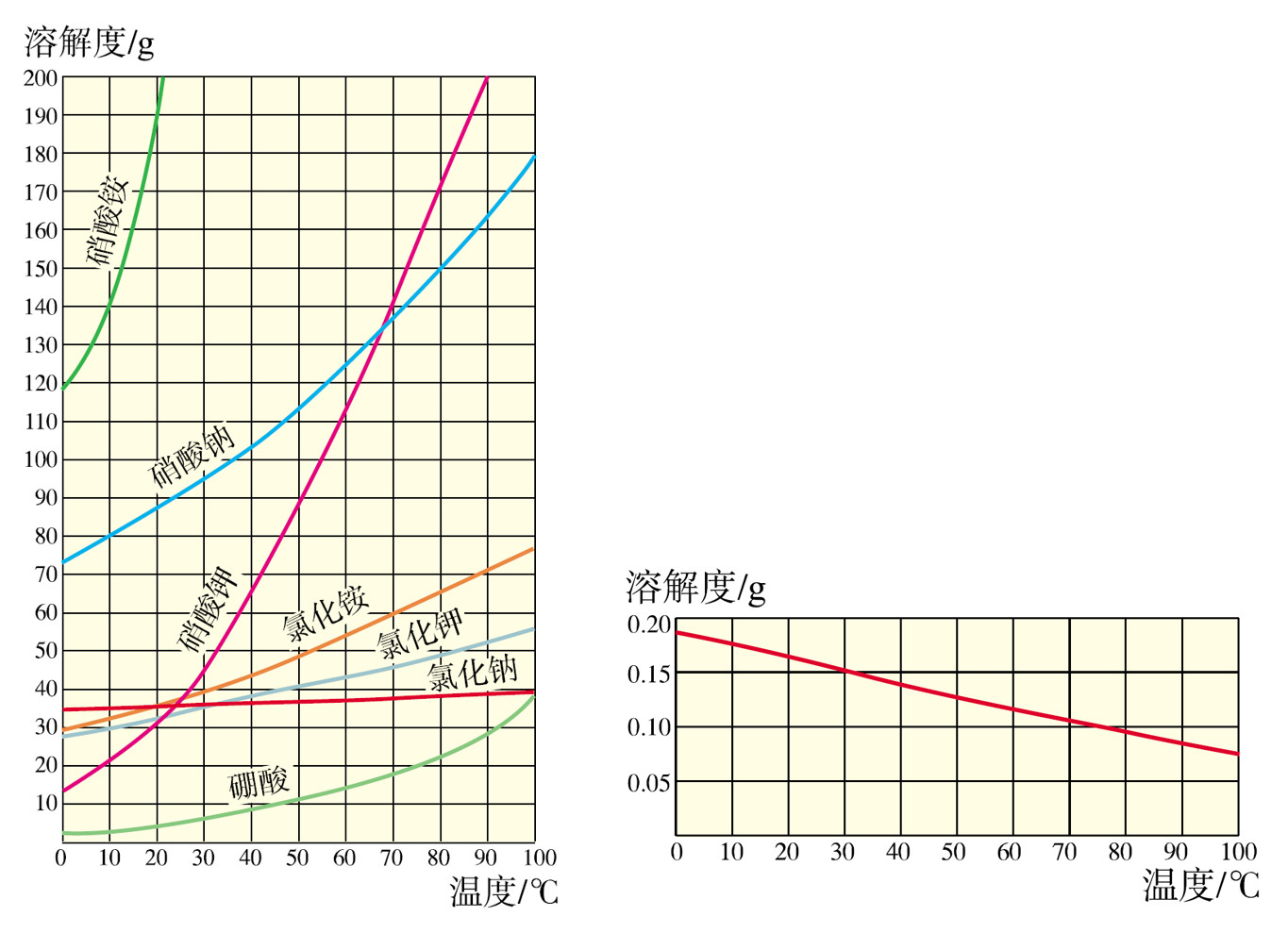
1.溶解度曲线的应用
(1)查出某物质在不同温度时的溶解度
(2)比较不同物质,在同一温度时溶解度的大小
(3)可以比较不同物质的溶解度受温度变化的影响大小
(4)可以看出物质溶解度随温度变化的规律
多数固体物质溶解度随温度升高而增大,如硝酸钾、氯化铵
少数固体物质溶解度受温度变化的影响较小,如氯化钠
极少数固体物质的溶解度随温度升高而减小,如氢氧化钙
五、溶解度与溶解性
比较20℃时的溶解度
<0.01g:难溶
0.01g~1g:微溶
1g~10g:可溶
>10g:易溶
六、气体溶解度
1.概念
该气体压强为101kpa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积
气体溶解度与压强和温度有关
温度越高,气体溶解度越小
压强越大,气体溶解度越大