知识清单
2026/1/19约 569 字...
3.2 原子结构
一、原子的构成
(1)原子的构成
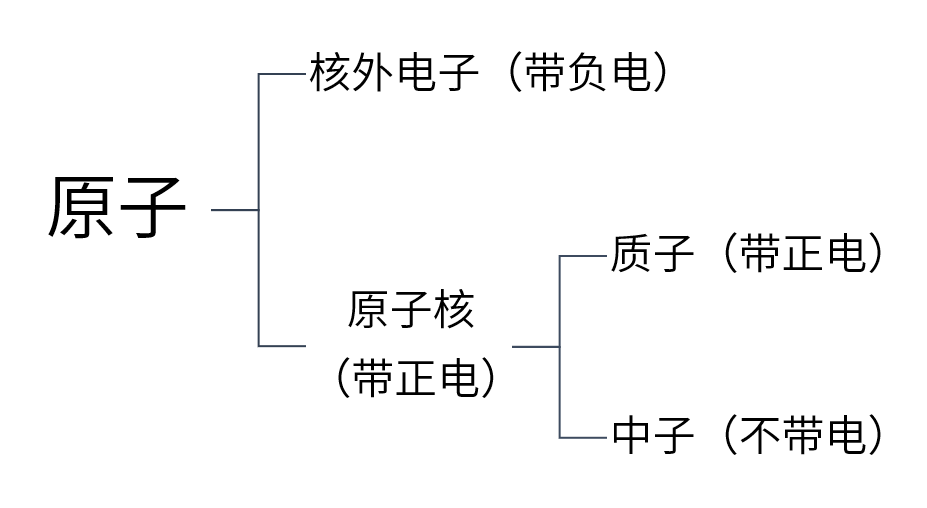
(2)原子内部结构规律
① 不同种类的原子质子数不同
②核电荷数=质子数=电子数=原子序数
③原子不显电性,因为原子核与核外电子所带电荷的电量相等,电性相反
(3)注意
①原子中质子数不一定等于中子数
②并不是所有的原子核中都有中子,氢原子没有中子(中子数为0)
二、原子核外电子排布(核外电子分层排布)
①先近后远,能量由低到高
②电子层(第1-7层)离核最远的叫最外层
③最外层电子数不超过8(只有一个电子层,不超过2)
④每层容纳电子数最多2n2个
三、离子
1.原子最外层电子数的特点
① 稀有气体的原子最外层电子数=8(He=2)(最外层电子数为8个电子的结构称为稳定结构,稳定结构是所有原子的共同愿望)
② 金属的原子最外层电子数<4(化学反应中易失去电子)
③非金属的原子最外层电子数>4(化学反应中易得到电子)
2.离子的概念
①带电的原子或原子团叫离子
②阳离子:带正电的原子叫阳离子
③阴离子:带负电的原子叫阴离子
四、原子和离子的区别与联系
1.原子不带电荷,而离子带电荷
2.离子具有稳定结构,而原子不一定(稀有气体原子具有稳定结构)
3.离子是由原子得失电子而形成的
五、相对原子质量
相对原子质量≈质子数+中子数
六、物质的构成
1.构成物质的三种基本微粒:分子、原子、离子
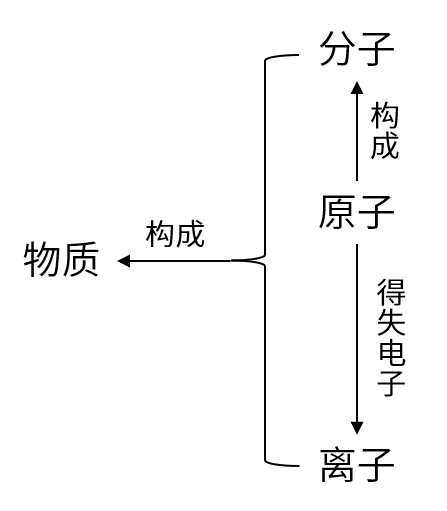
2.举例:
①汞由汞原子构成
②水由水分子构成(1个水分子由两个氢原子和一个氧原子构成)
③氯化钠由钠离子和氯离子构成