知识清单
一、常见的盐
盐:金属离子(铵根离子)与酸根离子构成的化合物
如:氯化钠(NaCl)、碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、碳酸钙(CaCO3)、高锰酸钾(KMnO4)、硫酸铜(CuSO4)、硝酸钠(NaNO3)
1.氯化钠(NaCl)
(1)NaCl是食盐的主要成分
(2)用途:
调味品、维持人的正常生理活动、医疗上配置生理盐水、用NaCl溶液选种、腌制食品、工业原料、消除公路积雪
(3)资源分布
海水、盐湖、盐井、盐矿
(4)制法
晾晒海水、煮盐井水、盐湖水,蒸发除去水分得到粗盐
粗盐中含有多种可溶性杂质(氯化镁、氯化钙)和不溶性杂质(泥沙)
粗盐通过溶解、沉淀、过滤、蒸发、结晶,可以得到初步提纯
2.Na2CO3
(1)俗名:苏打、纯碱
(2)用途:广泛用于玻璃、造纸、纺织和洗涤剂的生产
3.NaHCO3
(1)俗名:小苏打
(2)用途:发酵粉的主要成分,治疗胃酸过多
4.CaCO3
(1)大理石、石灰石、鸡蛋壳的主要成分
(2)用途:做建筑材料、补钙剂、制牙膏
二、碳酸盐的化学性质
1.与酸反应
2.碳酸钠与氢氧化钙反应
3.CO32-的检验
加稀盐酸-有大量气泡产生
将产生的气体通入澄清石灰水-澄清石灰水变浑浊
三、复分解反应
由两种化合物相互交换成分,生成另外两种化合物的反应
特点:价不变,互交换
通式:AB+CD=AD+CB
四、溶解性口诀
钾钠铵盐硝酸盐,都能溶于水中间
盐酸盐不溶只有银,硫酸盐不溶只有钡
碳酸盐只溶铵钾钠,碱只溶铵钾钠钡
五、复分解反应5大类
1.酸与金属氧化物反应
2.酸与碱反应
3.酸与盐反应
4.碱与盐反应
5.盐与盐反应
在初中化,复分解反应主要就是酸、碱、盐、金属氧化物之间的反应
大家碰到酸、碱、盐、金属氧化物之间的反应,可直接按照复分解反应的书写规律去写出相应的化学方程式
六、复分解反应发生的条件
只有当两种化合物相互交换成分,有气体或有沉淀或有水生成时,才是发生了复分解反应
气体:碳酸盐与酸,铵盐与碱
沉淀(常用8大沉淀):氯化银、硫酸钡、碳酸钙、碳酸钡、氢氧化镁、氢氧化铝、氢氧化铜(蓝色絮状沉淀)、氢氧化铁(红褐色沉淀)
水:酸与金属氧化物、酸与碱
七、盐的化学性质
1.盐 + 金属 → 盐 + 金属
2.盐 + 酸 → 盐 + 酸
3.盐 + 碱 → 盐 + 碱
4.盐 + 盐 → 盐 + 盐
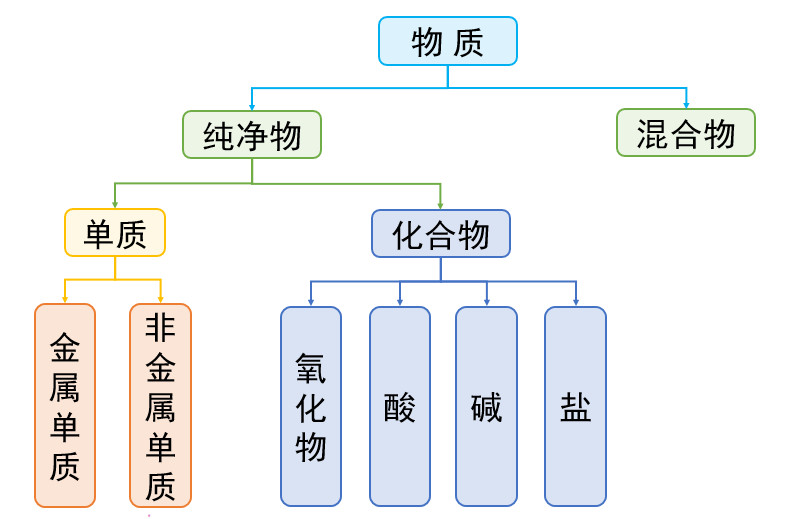
八、物质分类
九、化肥简介
农家肥:人畜粪便、植物体等
化学肥料:以化学和物理方法制成,含农作物生长所需营养元素(氮肥、磷肥、钾肥)
1.氮肥
(1)作用:促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质的含量
(2)举例:
尿素:CO(NH2)2
氯化铵:NH4Cl
硝酸钠:NaNO3
2.磷肥
(1)作用:增强作物抗寒、抗旱能力
(2)举例:
磷酸钙:Ca3(PO4)2
3.钾肥
(1)作用:增强抗病虫害和抗倒伏能力
(2)举例:
硫酸钾:K2SO4
氯化钾:KCl
氮、磷、钾肥功效的口诀:钾抗倒伏,磷抗旱,茎、叶茂盛要用氮
4.复合肥
化肥中同时还有氮、磷、钾中的两种或三种营养元素
举例:
磷酸二氢铵:NH4H2PO4
硝酸钾:KNO3
十、化肥、农药的利与弊
1.利
化肥:提高农作物产量
农药:消灭病虫害、杂草等,促高产、丰收
2.弊
土壤污染、水污染、大气污染、危害健康
3.农药化肥的使用
均衡适度、适时用药、减少污染
十一、侯氏制碱法
制取的是纯碱:Na2CO3